- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
BÀI TẬP AMIN
I. TOÁN ĐỐT CHÁY AMIN
PHƯƠNG PHÁP
* PHẢN ỨNG ĐỐT CHÁY AMIN
- Amin no đơn chức:
CnH2n+3N + O2 ➝ nCO2 + H2O + N2
- Amin thơm:
CnH2n-5N + O2 ➝ nCO2 + H2O + N2
- Amin tổng quát:
CxHyNt + O2 ➝ xCO2 + H2O + N2
* LƯU Ý:
- Khi đốt cháy một amin ta luôn có: nO2 phản ứng = nCO2 + ½ nH2O
- Khi đốt cháy một amin ngoài không khí thì: nN2 sau pư = nN2 sinh ra từ pư cháy amin + nN2 có sẵn trong không khí
VÍ DỤ 1
Đốt cháy hoàn toàn một amin no, đơn chức, bậc 1 mạch hở thu được tỉ lệ mol CO2 và H2O là 4:7. Tên amin là?
A.Etyl amin
B. Đimetyl amin
C. Metyl amin
D. Propyl amin
Công thức amin no đơn chức là CnH2n+3N
Phản ứng cháy có nCO2 : nH2O = 4 : 7
=> nC : nH = 2 : 7 = n : (2n + 3) => n = 2
=> Amin đơn chức là C2H7N
Amin bậc 2 => CH3NHCH3 (đimetyl amin)
Đáp án cần chọn là: C
VÍ DỤ 2
Đốt cháy hoàn toàn V lít hơi một amin X bằng một lượng oxi vừa đủ tạo ra 8V lít hỗn hợp gồm khí CO2 ; N2 và hơi H2O (các thể tích đo cùng điều kiện). Amin X tác dụng với axit nitrơ ở nhiệt độ thường giải phóng khí N2. Chất X là?
A. CH2=CH-NH-CH3
B. CH3-CH2-NH-CH3
C. CH3-CH2-CH2-NH2
D. CH2=CH-CH2-NH2
Theo gợi ý đáp án N = 1 → amin đơn chức
Gọi CT chung: CxHyN
CxHyN + (x + y/4)O2 → xCO2 + y/2H2O + 1/2N2
V xV y/2V 1/2V
Theo giả thuyết: xV + y/2V + 1/2V = 8V
→ 2x + y = 15
Điều kiện: y < hoặc = 2x + 3
Giá trị thỏa mãn là: x = 3 và y = 9
Mà X + HNO2 → N2 thì X là amin bậc 1.
→ Đáp án: C
VÍ DỤ 3
Hỗn hợp X gồm 1 mol aminoaxit no, mạch hở và 1 mol amin no, mạch hở. X có khả năng phản ứng tối đa với 2 mol HCl hoặc 2 mol NaOH. Đốt cháy hoàn toàn X thu được 6 mol CO2, x mol H2O và y mol N2. Các giá trị x và y tương ứng là?
A. 8 và 1,0
B. 8 và 1,5
C. 7 và 1,0
D. 7 và 1,5
Aminoaxit là CmH2m -1O4N, amin là CnH2n+3N
Phản ứng cháy: CmH2m -1O4N m CO2 +(2m-1)/2H2O +1/2N2
CnH2n+3N nCO2 +(2n+3)/2 H2O + 1/2N2
Số mol CO2 là : n + m =6 → nH2O = n + m + 1 = 7.
Số mol N2 = 1
Đáp án cần chọn là: c
II. AMIN TÁC DỤNG VỚI AXIT, MUỐI
1. PHẢN ỨNG VỚI DUNG DỊCH AXIT
Với amin A, bậc 1, có a nhóm chức:
R(NH2)a + aHCl ➝R(NH3Cl)a
Số nhóm chức amin:
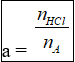
mmuối= mamin+ mHCl(ĐLBTKL)
2. VỚI DUNG DỊCH MUỐI CỦA KIM LOẠI
Một số muối dễ tạo kết tủa hidroxit với dung dịch amin.
AlCl3 + 3CH3NH2 + 3H2O ➝ Al(OH)3 + 3CH3NH3Cl
* Lưu ý: tương tự NH3, các amin cũng tạo phức chất tan với Cu(OH)2, Zn(OH)2, AgCl...
Ví Dụ: Sục khí CH3NH2 tới dư vào dung dịch CuCl2 thì hiện tượng xảy ra?
2CH3NH2 + CuCl2 + 2H2O ➝ Cu(OH)2 + 2CH3NH3Cl
Xanh nhạt
Cu(OH)2 + 4CH3NH2 ➝ [Cu(CH3NH2)4](OH)2
Phức tan màu xanh thẫm
VÍ DỤ 1:Cho 9,3g một amin no, đơn chức, bậc 1 tác dụng với dung dịch FeCl3 dư, thu được 10,7g kết tủa. CTPT của amin là?
A. CH3NH2 B. C2H5NH2 C. C3H7NH2 D. C4H9NH2
Dựa vào đáp án ⇒ X là amin đơn chức, ankyl là gốc hidrocacbon no ⇒ X: CnH2n+1NH2
3CnH2n+1NH2 + FeCl3 + 3H2O → 3CnH2n+1NH3Cl + Fe(OH)3
=> MCnH2n+1NH2 = 9,3 : 0,3 = 31 (g/mol)
=> 14n + 17 = 31
=> n = 1
=> công thức là CH3NH2
VÍ DỤ 2: Muối C6H5N2+Cl- (Phenylđiazoni) được sinh ra khi cho C6H5NH2 tác dụng với NaNO2 trong HCl ở nhiệt độ thấp (0 – 5oC). Để điều chế được 14,05g C6H5N2+Cl- ( H = 100%) thì lượng C6H5NH2 và NaNO2 cần dùng vừa đủ là?
A. 0,1 mol và 0,4 mol
B. 0,1 mol và 0,2 mol
C. 0,125 mol và 0,125 mol
D. 0,1 mol và 0,3 mol
Phương trình phản ứng :
C6H5NH2 + NaNO2 + 2HCl ➜ C6H5N2+Cl-+ 2H2O + NaCl (1)
mol: 0,1 0,1 0,1
Theo (1) và giả thiết ta có :
nC6H5NH2 =nNaNO2=nC6H5N2+Cl-=0,1 mol
Hiệu suất 80% =>thực tế cần dùng là
nNaNO2=nC6H5N2+Cl-=0,1:80%=0.125
Đáp án cần chọn là: C