PHẢN ỨNG HÓA HỌC
I. SỐ OXI HÓA VÀ CÁCH XÁC ĐỊNH SỐ OXI HÓA
1. KHÁI NIỆM VỀ SỐ OXI HÓA
Là ĐIỆN TÍCH của nguyên tử nguyên tố đó, nếu GIẢ ĐỊNH rằng liên kết giữa các nguyên tử trong phân tử đều là liên kết ION.
2. QUY TẮC XÁC ĐỊNH SỐ OXI HÓA
- QUY TẮC 1 : Số oxi hóa của các nguyên tố trong ĐƠN CHẤT bằng 0.
VD. Số oxi hóa của các nguyên tố Na, Fe, H, O, Cl trong đơn chất tương ứng Na, Fe, H2, O2, Cl2 đều bằng 0.
- QUY TẮC 2 : Trong hầu hết các HỢP CHẤT:
Số oxi hóa của H là +1 (trừ các hợp chất của H với kim loại như NaH, CaH2, thì H có số oxi hóa –1).
Số oxi hóa của O là –2 (trừ một số trường hợp như H2O2, F2O, oxi có số oxi hóa lần lượt là : –1, +2).
- QUY TẮC 3 : Trong một PHÂN TỬ, TỔNG đại số số oxi hóa của các nguyên tố bằng 0. Theo quy tắc này, ta có thể tìm được số oxi hóa của một nguyên tố NÀO ĐÓ trong phân tử nếu biết số oxi hóa của các nguyên tố CÒN LẠI.
VD. Tìm số oxi hóa của S trong phân tử H2SO4 ?
Gọi số oxi hóa của S trong H2SO4 là x, ta có:
2.(+1) + 1.x + 4.(–2) = 0 => x = +6
Vậy số oxi hóa của S là +6
- QUY TẮC 4 : Trong ION ĐƠN NGUYÊN TỬ, số oxi hóa của nguyên tử bằng ĐIỆN TÍCH của ion đó. Trong ion ĐA NGUYÊN TỬ, TỔNG đại số số oxi hóa của các nguyên tử trong ion đó bằng ĐIỆN TÍCH của nó.
VD. Số oxi hóa của Na, Zn, S và Cl trong các ion Na+, Zn2+, S2-, Cl- lần lượt là : +1, +2, –2, –1.
Tổng đại số số oxi hóa của các nguyên tố trong các ion SO42-, MnO4-, NH4+ lần lượt là : –2, –1, +1.
VD. Tìm số oxi hóa của Mn trong ion MnO4- ?
Gọi số oxi hóa của Mn là x, ta có :
1.x + 4.( –2) = –1 => x = +7
Vậy số oxi hóa của Mn là +7.
CHÚ Ý : Biểu diễn SỐ OXI HOÁ thì viết DẤU TRƯỚC, SỐ SAU.
Biểu diễn ĐIỆN TÍCH tích của ion thì viết SỐ TRƯỚC, DẤU SAU.
Nếu điện tích là 1+ (hoặc 1–) có thể viết đơn giản là + (hoặc -).
Thì đối với số oxi hóa phải viết đầy đủ cả dấu và chữ số (+1 hoặc –1).
TRONG HỢP CHẤT, kim loại kiềm, kiềm thổ, nhôm luôn có số oxi hóa lần lượt là : +1, +2, +3.
II. CÁC KHÁI NIỆM CẦN NẮM VỮNG
1. CHẤT KHỬ
- Là chất NHƯỜNG electron, sau phản ứng số oxi hóa của nó TĂNG lên.
2. CHẤT OXI HÓA
- Là chất NHẬN electron, sau phản ứng số oxi hóa của nó GIẢM xuống.
3. SỰ OXI HÓA
- Là sự NHƯỜNG electron.
- Như vậy chất KHỬ có quá trình oxi hóa hay bị oxi hóa.
4. SỰ KHỬ
- Là sự NHẬN electron.
- Như vậy chất OXI HOÁ có quá trình khử hay bị khử.
5. SẢN PHẨM KHỬ
- Là sản phẩm SINH RA từ quá trình khử.
6. SẢN PHẨM OXI HÓA
- Là sản phẩm SINH RA từ quá trình oxi hóa.
CÁCH NHỚ
- Đối với CHẤT oxi hóa và chất khử: “KHỬ CHO O NHẬN” (O là chất oxi hóa).
- Đối với QUÁ TRÌNH oxi hóa, khử thì ngược lại:
-
-
-
- Chất oxi hóa tham gia quá trình khử.
- Chất khử tham gia quá trình oxi hóa.
-
-
TỔNG KẾT
PHẢN ỨNG OXI HOÁ – KHỬ là phản ứng hóa học xảy ra trong đó có sự CHUYỂN electron giữa CÁC CHẤT PHẢN ỨNG hoặc là phản ứng hóa học trong đó có SỰ THAY ĐỔI số oxi hóa của một hoặc nhiều nguyên tố.
CHÚ Ý
- Do electron KHÔNG tồn tại ở trạng thái TỰ DO nên hai quá trình oxi hóa và khử luôn xảy ra ĐỒNG THỜI.
(tức là có quá trình oxi hóa thì phải có quá trình khử và NGƯỢC LẠI).
- Tổng số electron do chất khử (nhường) BẰNG tổng số electron do chất oxi hóa (nhận).
III. CÂN BẰNG PHƯƠNG TRÌNH PHẢN ỨNG OXI HOA-KHỬ
1. NGUYÊN TẮC
- Dựa vào sự BẢO TOÀN ELECTRON nghĩa là tổng số electron của chất khử cho phải BẰNG tổng số electron chất oxi hóa nhận.
2. CÁC BƯỚC CÂN BẰNG
B1: Viết sơ đồ phản ứng với các nguyên tố có sự thay đổi số oxi hóa.
B2: Viết các quá trình: khử (cho electron), oxi hóa (nhận electron).
B3: Cân bằng electron: nhân hệ số để: Tổng số electron CHO = tổng số electron NHẬN.
(tổng số oxi hóa GIẢM = tổng số oxi hóa TĂNG).
B4: Cân bằng nguyên tố không thay đổi số oxi hoá (thường theo thứ tự):
-
- Kim loại (ion dương).
- Gốc axit (ion âm).
- Môi trường (axit, bazơ).
- Nước (cân bằng H2O để cân bằng hiđro).
B5: Kiểm soát số nguyên tử oxi ở 2 vế (phải bằng nhau).
* LƯU Ý
- Khi viết các quá trình oxi hoá và quá trình khử của từng nguyên tố, cần theo đúng chỉ số qui định của nguyên tố đó.
VD. Fe0 + H2S+6O4 đặc nóng → Fe+32(SO4)3 + S+4O2 + H2O
chất khử chất oxi hóa
1 x 2Fe0 → 2Fe+3 + 6e
3 x S+6 + 2e → S+4
2Fe + 6H2SO4 → Fe2(SO4)3 +3SO2 + 6H2O
IV. CHIỀU XẢY RA PHẢN ỨNG OXI HÓA - KHỬ
Khi một chất KHỬ gặp một chất OXI HOÁ liệu có xảy ra phản ứng hóa học trong MỌI trường hợp không?
Thực tế không phải như vậy.
Phản ứng oxi hóa khử xảy ra THEO CHIỀU:
Chất oxi hóa MẠNH phản ứng với chất khử MẠNH tạo ra chất oxi hóa YẾU HƠN và chất khử YẾU HƠN.
V. DỰ ĐOÁN TÍNH CHẤT CỦA 1 HỢP CHẤT DỰA VÀO SỐ OXI HÓA
- Một nguyên tố có thể tồn tại ở nhiều trạng thái oxi hóa (số oxi hóa) KHÁC NHAU.
VD. N có thể có các số oxi hóa: –3, 0, +1, +2, +3, +4, +5.
S có thể có các số oxi hóa: –2, 0, +4, +6.
* NHẬN XÉT: Căn cứ vào TRẠNG THÁI oxi hóa có thể DỰ ĐOÁN tính chất oxi hóa, khử của các nguyên tố trong phân tử.
- Nếu một nguyên tố tồn tại ở trạng thái oxi hóa CAO NHẤT thì chỉ có thể GIẢM số oxi hóa
=> chỉ có thể đóng vai trò là CHẤT OXI HOÁ.
- Nếu một nguyên tố tồn tại ở trạng thái oxi hóa THẤP NHẤT thì chỉ có thể TĂNG số oxi hóa
=> chỉ có thể đóng vai trò là CHẤT KHỬ.
- Nếu một nguyên tố tồn tại ở trạng thái oxi hóa TRUNG GIAN thì có thể TĂNG số oxi hóa hoặc có thể GIẢM số oxi hóa
=> có thể đóng vai trò là CHẤT OXI HOÁ hoặc CHẤT KHỬ.
- Nếu một chất cấu tạo bởi HAI thành phần, một có tính OXI HOÁ, một có tính KHỬ
=> thì chất đó VỪA có tính oxi hóa, VỪA có tính khử.
- Nếu một chất có thể tham gia phản ứng oxi hóa – khử NỘI PHÂN TỬ hoặc tham gia phản ứng TỰ OXI HOÁ – KHỬ
=> thì chất đó VỪA có tính oxi hóa, VỪA có tính khử.
VD.
Trong NH3, N có số oxi hóa –3 là số oxi hóa THẤP NHẤT nên chỉ có thể TĂNG số oxi hóa
=> chỉ có thể đóng vai trò là CHẤT KHỬ trong các phản ứng hóa học.
Trong HNO3, N có số oxi hóa +5 là số oxi hóa CAO NHẤT nên chỉ có thể GIẢM số oxi hóa
=> chỉ có thể đóng vai trò là CHẤT OXI hóa.
Trong NO2, N có số oxi hóa TRUNG GIAN là +4
=> có thể là CHẤT OXI HOÁ hay CHẤT KHỬ.
Trong phân tử FeCl3, Fe có số oxi hóa CAO NHẤT là +3 => đóng vai trò là chất OXI HOÁ.
Cl có số oxi hóa THẤP NHẤT => đóng vai trò là chất KHỬ.
=> Vậy phân tử FeCl3 VỪA có tính oxi hóa, VỪA có tính khử.
Phân tử Fe(NO3)3 có thể tham gia phản ứng oxi hóa khử NỘI PHÂN TỬ
=> Fe(NO3)3 VỪA có tính oxi hóa, VỪA có tính khử.
Fe(NO3)3 → Fe2O3 + NO2 + O2
VI. XÁC ĐỊNH SẢN PHẨM CỦA PHẢN ỨNG OXI HÓA - KHỬ
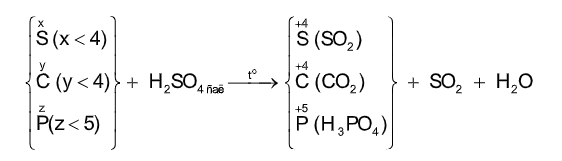
Với H2SO4đặc tùy BẢN CHẤT của chất khử và NỒNG ĐỘ của axit mà S+6 có thể bị khử xuống các trạng thái oxi hóa KHÁC NHAU:
S+4 (SO2), S0 (S), S-2 (H2S)
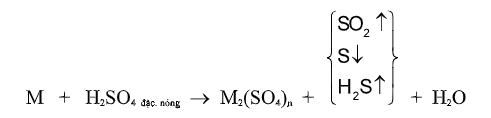
(M là kim loại, n số oxi hóa cao của kim loại)
VD. (1) 2Fe + 6H2SO4 đặc, nóng → Fe2(SO4)3 + 3SO2 + 6H2O
(2) 3Zn + 4H2SO4 đặc, nóng → 3ZnSO4 + S + 4H2O
(3) 4Mg + 5H2SO4 đặc, nóng → 4MgSO4 + H2S + 4H2O
(4) C + 2H2SO4 đặc, nóng → CO2 + 2SO2 + 2H2O
(5) 2P + 5H2SO4 đặc, nón → 2H3PO4 + 5SO2 + 2H2O
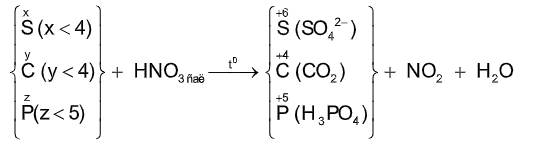
Với HNO3 tùy theo BẢN CHẤT của chất khử và nồng độ của axit mà N+5 bị khử xuống các trạng thái oxi hóa khác nhau:
N+4(NO2), N+2(NO), N+1(N2O), N0(N2), N-3(NH4NO3).
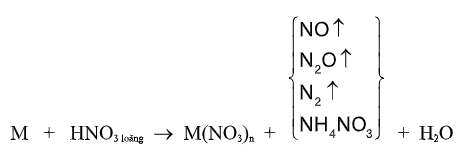
(M là kim loại, n số oxi hóa cao của kim loại)
VD. (1) Fe + 6HNO3 đặc, nóng → Fe(NO3)3 + 3NO2 + 3H2O
(2) Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
(3) 8Al + 30HNO3 loãng → 8Al(NO3)3 + 3N2O + 15H2O
(4) 4Zn + 10HNO3 loãng → 4Zn(NO3)2 + NH4NO3 + 3H2O
(5) C + 4HNO3 đặc, nóng → CO2+ 4NO2 + 2H2O
(6) P + 5HNO3 đặc, nóng → H3PO4 + 5NO2 + H2O
- Các chất khử khi bị oxi hóa bởi KMnO4 thì số oxi hóa biến đổi như sau:
Với KMnO4 tùy theo MÔI TRƯỜNG xảy ra phản ứng mà Mn+7bị khử xuống các trạng thái oxi hóa khác nhau:
-
- Môi trường axit (H+) : Mn+7 → Mn+2 (tồn tại ở dạng muối Mn2+)
- Môi trường trung tính (H2O) : Mn+7→ Mn+4 (tồn tại ở dạng MnO2)
- Môi trường kiềm (OH-) : Mn+7 → Mn+6 (tồn tại ở dạng K2MnO4)
VD. (1) 2KMnO4 + 10KI + 8H2SO4 → 2MnSO4 + 5I2 + 6K2SO4 + 8H2O
(2) 2KMnO4 + 6KI + 4H2O→2MnO2 + 3I2 + 8KOH
(3) 2KMnO4 + H2O2 + 2KOH →2K2MnO4 + O2 + 2H2O