NGUYÊN TỬ
1. CẤU TẠO NGUYÊN TỬ
- Nguyên tử có khối lượng rất nhỏ dùng đơn vị là 1u=1/12 khối lượng nguyên tử cacbon
- Gồm:
- Vỏ nguyên tử: gồm các hạt electron mang điện âm (-)
- Hạt nhân: gồm các hạt
- Notron không mang điện
- Proton mang điện dương (+)
- Số hạt electron bằng số hạt protron nên nguyên tử trung hòa về điện.
- Các hạt có khối lượng rất nhỏ, trong đó hạt electron nhỏ hơn nhiều 2 hạt còn lại nên khối lượng nguyên tử được tính bằng tổng khối lượng của p và n
- Khối lượng nguyên tử = Mp + Me + Mn = Mp + Mn
2. LỚP VÀ PHÂN LỚP ELECTRON
a. LỚP ELECTRON
- Lớp electron gồm các electron có mức năng lượng gần bằng nhau.
- Các lớp electron xếp theo thứ tự mức năng lượng từ thấp đến cao (từ gần nhân ra ngoài).
|
K |
L |
M |
N |
O |
P |
Q |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
b. PHÂN LỚP ELECTRON
- Mỗi lớp electron chia thành các phân lớp s, p, d, f gồm các electron có mức năng lượng bằng nhau:
- Mỗi lớp có số lượng obitan khác nhau. 1AO(obitan) chứa 2 electron
|
s |
p |
d |
f |
|
1AO |
3AO |
5AO |
7AO |
- Trong 1 lớp electron thì số phân lớp = số thứ tự lớp:
|
1(K) |
2(L) |
3(M) |
4(N) |
5 trở lên |
|
1 phân lớp s |
1 phân lớp s 1 phân lớp p |
1 phân lớp s 1 phân lớp p 1 phân lớp d |
1 phân lớp s 1 phân lớp p 1 phân lớp d 1 phân lớp f |
Giống lớp 4 |
- Phân lớp electron chứa electron tối đa gọi là phân lớp electron bão hòa.
LƯU Ý
-
- Khi phân lớp có tối đa số e ta có cấu hình bão hoà bền.
- Khi phân lớp có 1/2 số e tối đa ta có cấu hình bán bão hoà khá bền.
VD. p3;d5;f7
3. CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
-MỨC NĂNG LƯỢNG
Trật tự mức năng lượng : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s ...
(Mức năng lượng tăng dần)
- Cấu hình electron nguyên tử biểu diễn SỰ PHÂN BỐ electron trên các phân lớp thuộc các lớp khác nhau.
- Người ta quy ước cách viết cấu hình electron nguyên tử như sau :
- Số thứ tự lớp electron được ghi bằng chữ số (1, 2, 3...).
- Phân lớp được ghi bằng các chữ cái thường (s, p, d, f).
- Số electron trong một phân lớp được ghi bằng số ở phía trên bên phải của phân lớp (s2, p6,...)
-CẤU HÌNH ELECTRON
- Sự phân bố các electron vào obitan trong nguyên tử tuân theo các quy tắc và nguyên lí :
Nguyên lí Pauli : Trên một obitan có thể có nhiều nhất hai electron và hai electron này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi obitan.
Nguyên lí vững bền : Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt những obitan có mức năng lượng từ thấp đến cao.
Quy tắc Hun : Trong cùng một phân lớp, các electron sẽ phân bố trên obitan sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.
- Cách viết cấu hình electron trong nguyên tử :
Xác định số electron
Sắp xếp các electron vào phân lớp theo thứ tự tăng dần mức năng lượng
Viết electron theo thứ tự các lớp và phân lớp.
VD:Viết cấu hình electron của Fe (Z = 26)
4. ĐẶC ĐIỂM CỦA LỚP ELECTRON NGOÀI CÙNG
- Các electron lớp ngoài cùng QUYẾT ĐỊNH tính chất hóa học của một nguyên tố.
- Số electron lớp ngoài cùng TỐI ĐA là 8e.
-
- Các nguyên tử kim loại: 1e, 2e, 3e lớp ngoài cùng.
- Các nguyên tử phi kim: 5e, 6e, 7e lớp ngoài cùng.
- Các nguyên tử khí hiếm: 8e (He có 2e) lớp ngoài cùng.
- Các nguyên tử có 4e lớp ngoài cùng có thể là kim loại (Ge, Sn, Pb) có thể là phi kim (C, Si).
5. ĐỒNG VỊ
- CÙNG: số p, e, tên gọi, kí hiệu hoá học, cùng vị trí trong bảng tuần hoàn.
- KHÁC: số n, tính chất vật lý.
VD. Nguyên tố H có 3 đồng vị.
![]()
- khối lượng nguyên tử trung bình:
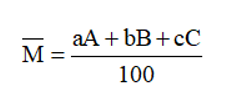
Với: a, b, c là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
A, B, C là nguyên tử khối (hay số khối) của mỗi đồng vị.
VD. Nguyên tố Cacbon có 2 đồng vị bền 126C chiếm 98,89% và 136C chiếm 1,11%. Nguyên tử khối trung bình của cacbon là:
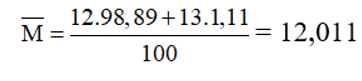
- Điện tích hạt nhân Z = số p = số e.
- Số khối A = Z + N.