TỐC ĐỘ PHẢN ỨNG
I. KHÁI NIỆM
1. TỐC ĐỘ PHẢN ỨNG
- Là độ biến thiên nồng độ của một chất trong các phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Trong đó theo quy ước:
- Nồng độ theo mol/lít
- Thời gian có thể là giây (s), phút (ph), giờ (h)...
- Tốc độ phản ứng được xác định bằng thực nghiệm.
2. TỐC ĐỘ TRUNG BÌNH
- Là tốc độ biến thiên trung bình nồng độ của một chất trong khoảng thới gian t1 đến t2.
VD. Xét phản ứng aA → bB
- Nếu tính tốc độ phản ứng theo chất A: Ở thời điểm t1 chất A có nồng độ C1 mol/lít, ở thời điểm t2 chất A có nồng độ C2 mol/lít.
Tốc độ trung bình của phản ứng là: 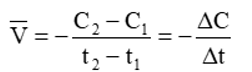
- Nếu tính tốc độ phản ứng theo chất B:
Tốc độ trung bình của phản ứng là: 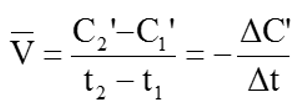
- Để tốc độ phản ứng là đơn giá trị người ta sử dụng biểu thức: 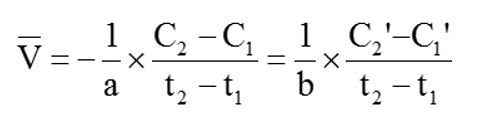
II. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN TỐC ĐỘ PHẢN ỨNG HÓA HỌC
- Khi TĂNG NỒNG ĐỘ của chất phản ứng thì tốc độ phản ứng TĂNG.
- Đối với các phản ứng hóa học có CHẤT KHÍ tham gia, khi TĂNG ÁP SUẤT thì tốc độ phản ứng TĂNG.
- Khi TĂNG NHIỆT ĐỘ thì tốc độ phản ứng TĂNG.
Thông thường khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng tăng lên 2- 4 lần.
Ta có:
Trong đó:
![]()
Vt1 là tốc độ phản ứng ở nhiệt độ ban đầu(t1)
Vt2 là tốc độ phản ứng ở nhiệt độ cao hơn(t2)
γ là hệ số nhiệt của tốc độ (cho biết tốc độ phản ứng tăng lên bao nhiêu lần khi = 10oC.
- Đối với các phản ứng hóa học có CHẤT RẮN tham gia thì khi TĂNG DIỆN TÍCH BỀ MẶT, tốc độ phản ứng TĂNG.
- Chất xúc tác làm tăng tốc độ phản ứng, nhưng KHÔNG TIÊU HAO trong quá trình phản ứng.
- Chất ức chế phản ứng là chất làm GIẢM TỐC ĐỘ PHẢN ỨNG, nhưng không bị tiêu hao trong quá trình phản ứng.
III. BIỂU THỨC THỰC NGHIỆM TỐC ĐỘ PHẢN ỨNG
mA+nB➜pC+qD
v = k [A]m[B]n
Trong đó:
k là hằng số tốc độ phản ứng, chỉ phụ thuộc vào nhiệt độ và bản chất các phản ứng.