BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ HÓA HỌC
- Các nguyên tố hóa học được xếp vào bảng tuần hoàn DỰA TRÊN các nguyên tắc sau:
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng ngang (chu kì).
- Các nguyên tố có cùng số electron hóa trị (electron có khả năng tham gia vào quá trình hình thành liên kết hóa học) được xếp thành một cột (nhóm).
II. CẤU TẠO BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. Ô NGUYÊN TỐ
Số thứ tự của ô nguyên tố ĐÚNG BẰNG số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân).
2. CHU KÌ VÀ NHÓM
| CHU KÌ |
VD. 12Mg: 1s22s22p63s2 => Mg thuộc chu kì 3 vì có 3 lớp electron. |
| NHÓM |
Số thứ tự nhóm A = tổng số e lớp ngoài cùng.
* Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B. * Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB. * Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B. |
| Khối các nguyên tố s |
Gồm các nguyên tố nhóm IA và IIA Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s. VD. 11Na: 1s22s22p63s1 |
| Khối các nguyên tố p |
Gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He). Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p. VD. 13Al: 1s22s22p63s2 3p1 |
| Khối các nguyên tố f |
Gồm các nguyên tố thuộc họ Lantan và họ Actini. Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f. VD. 58Ce: 1s22s22p63s2 3p63d104s24p64f25s25p66s2 |
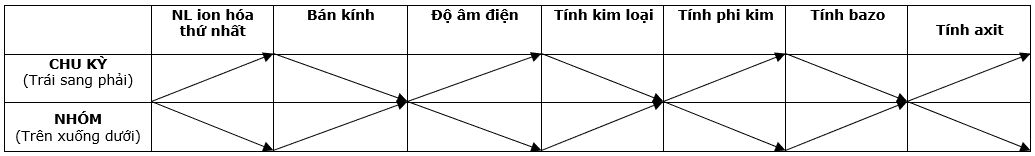
3. CÁC TÍNH CHẤT CỦA NGUYÊN TỐ
Một số tính chất của nguyên tố biến thiên theo bảng sau: