- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
CHƯƠNG 1. ĐẠI CƯƠNG HOÁ HỮU CƠ
I. HỢP CHẤT HỮU CƠ VÀ HOÁ HỌC HỮU CƠ
1. KHÁI NIỆM
- Là các hợp chất của C trừ oxit của C, muối cacbua, muối cacbonat, muối xianua.
2. PHÂN LOẠI
Hợp chất hữu cơ được CHIA thành HIDROCACBON và DẪN XUẤT HIDROCACBON.
|
HIDRCACBON Là loại hợp chất hữu cơ đơn giản NHẤT, trong thành phần phân tử CHỈ chứa HAI nguyên tố là cacbon và hidro. |
|
| Hidrocacbon MẠCH HỞ |
Hidrocacbon NO: Ankan CH4 Hidrocacbon KHÔNG NO có một nối đôi: Anken C2H4 Hidrcacbon KHÔNG NO có hai nối đôi: Ankadien |
| Hidrocacbon MẠCH VÒNG |
Hidrocacbon NO: xicloankan Hidrocacbon mạch THƠM: Aren |
|
DẪN XUẤT HIDROCACBON Là những hợp chất mà trong phân tử ngoài C, H ra còn có một số hay nhiều nguyên tố khác như O, N, S, halogen... |
|
| Dẫn xuất HALOGEN |
R – X ( R là gốc hidrocacbon) |
| Hợp chất chứa NHÓM CHỨC |
- OH - : ancol - O - : ete - COOH: axit...... |
3. ĐẶC ĐIỂM CHUNG
- Hợp chất hữu cơ NHẤT THIẾT phải chứa C, hay có H THƯỜNG GẶP O ngoài ra còn có halogen, N, P...
- Liên kết CHỦ YẾU trong hợp chất hữu cơ là liên kết cộng hóa trị.
- Các hợp chất hữu cơ thường DỄ BAY HƠI, DỄ CHÁY, KÉM BỀN NHIỆT.
- Các phản ứng trong hoá học hữu cơ thường CHẬM, KHÔNG hoàn toàn, xảy ra theo NHIỀU hướng, thường PHẢI đun nóng và có xúc tác.
4. ĐỒNG ĐẲNG ĐỒNG PHÂN
| ĐỒNG ĐẲNG |
- Là hiện tượng các chất hữu cơ có CẤU TẠO và TÍNH CHẤT HOÁ HỌC tương tự nhau. - Thành phần phân tử KHÁC NHAU một hay nhiều nhóm CH2. - Các chất thuộc CÙNG KIỂU CTPT hợp thành một dãy đồng đẳng có công thức CHUNG. |
| ĐỒNG PHÂN |
- Đồng phân là các chất hữu cơ có CÙNG công thức phân tử. - Có cấu tạo KHÁC NHAU. => Tính chất hóa học khác nhau. - Cần chú ý phân biệt đồng phân CẤU TẠO và đồng phân LẬP THỂ (đồng phân cis – trans). |
5. DANH PHÁP
- TÊN THÔNG THƯỜNG: Thường đặt theo nguồn gốc tìm ra chúng, đôi khi có phần đuôi để chỉ rõ hợp chất loại nào.
- TÊN HỆ THỐNG THEO DANH PHÁP IUPAC
-
- Tên gốc – chức: gồm Tên phần gốc – Tên phần định chức.
VD. C2H5 – Cl: Etyl clorua
C2H5 – O – CH3: Etyl metyl ete
Iso và neo viết liền, sec- và tert- có dấu gạch nối "-"
-
- Tên thay thế: Được viết liền, không viết cách như tên gốc chức, phân làm ba phần như sau:
Tên phần thế (có thể không có) + Tên mạch cacbon chính + (bắt buộc phải có) + Tên phần định chức (bắt buộc phải có)
VD. H3C – CH3: et+an (etan)
C2H5 – Cl: clo+et+an (cloetan)
CH3 – CH=CH – CH3: but-2-en
CH3 – CH(OH) – CH = CH2: but-3-en-2-ol
CHÚ Ý: Thứ tự ưu tiên trong mạch như sau:
-COOH > -CHO > -OH > -NH2 > -C=C > -C≡CH > nhóm thế
VD. OHC-CHO: etanđial
HC≡C-CH2-CH2-C(CH=CH2)=CH-CHO: 3-vinylhept-2-en-6-inal
OHC-C≡C-CH2-CH2-C(CH=CH2)=CH-CHO: 3-vinyloct-2-en-6-inđial
Tên số đếm và tên mạch cacbon chính
|
SỐ ĐẾM |
MẠCH CACBON CHÍNH |
|
|
1 |
Mono |
Met |
|
2 |
Đi |
Et |
|
3 |
Tri |
Prop |
|
4 |
Tetra |
But |
|
5 |
Penta |
Pent |
|
6 |
Hexa |
Hex |
|
7 |
Hepta |
Hept |
|
8 |
Octa |
Oct |
|
9 |
Nona |
Non |
|
10 |
Đeca |
Đec |
|
Cách nhớ: Mẹ Em Phải Bón Phân Hóa Học Ở Ngoài Đồng |
||
Tên một số gốc (nhóm) hiđrocacbon thường gặp
a) Gốc (nhóm) no ankyl: (từ ankan ta bớt đi 1H được nhóm ankyl)
| CH3- | metyl |
| CH3-CH2- | etyl |
| CH3-CH2-CH2- | propyl |
| CH3-CH(CH3)- | isopropyl |
| CH3[CH2]2CH2- | butyl |
| CH3-CH(CH3)-CH2- | isobutyl |
| CH3-CH2-CH(CH3)- | sec-butyl |
| (CH3)3C- | tert-butyl |
| CH3-CH(CH3)-CH2-CH2- | isoamyl |
b) Gốc (nhóm) không no:
-
-
- CH2=CH-: vinyl
- CH2=CH-CH2-: anlyl
-
c) Gốc (nhóm) thơm:
-
-
- C6H5-: phenyl
- C6H5-CH2-: benzyl
-
d) Gốc (nhóm) anđehit-xeton:
-
-
- -CHO: fomyl
- -CH2-CHO: fomyl metyl
- CH3-CO-: axetyl
- C6H5CO-: benzoyl
-
II. PHÂN TÍCH HỢP CHẤT HỮU CƠ
1. PHÂN TÍCH NGUYÊN TỐ
-Phân tích định tính:
- Mục đích: xác định các nguyên tố có trong HCHC.
- Nguyên tắc: chuyển các nguyên tố trong HCHC thành các chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng.
-Phân tích định lượng:
- Mục đích: Xác định tỉ lệ khối lượng (hàm lượng) các nguyên tố có trong HCHC.
- Nguyên tắc: “chuyển” các nguyên tố trong HCHC thành các chất vô cơ đơn giản rồi định lượng chúng bằng phương pháp khối lượng, phương pháp thể tích hoặc phương pháp khác.
2. THIẾT LẬP CÔNG THỨC PHÂN TỬ
-CTPT: cho ta biết số nguyên tử của các nguyên tố có trong phân tử.
-Cách thiết lập CTPT:
Cách 1: từ CTĐGN, kết hợp với khối lượng phân tử của HCHC.
Biết CTĐGN của A là: CaHbOcNd.
MA.
Lúc đó CTPT của A là: (CaHbOcNd)n thì:
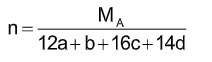
Cách 2: không qua CTĐGN.
- Dựa vào khối lượng hoặc phần trăm khối lượng của các nguyên tố:
CTPT của A là CxHyOzNt thì:
![]()
hoặc
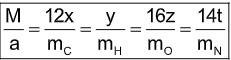
Với a là khối lượng hợp chất A.
Từ đó suy ra x, y, z, t CTPT
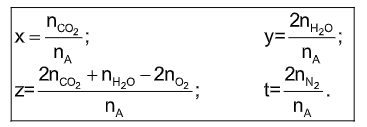
- Tính trực tiếp từ phản ứng đốt cháy:
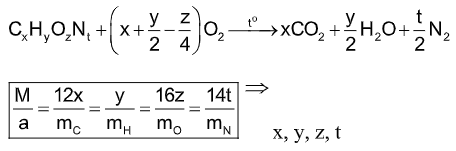
Sau đó với M suy ra z từ đó có CTPT.
III. LIÊN KẾT TRONG HÓA HỌC HỮU CƠ
- Liên kết hóa học thường gặp nhất trong phân tử các hợp chất hữu cơ là liên kết CỘNG HÓA TRỊ.
- Liên kết cộng hóa trị được chia thành hai loại:
-
- Liên kết XÍCH MA (σ).
- Liên kết PI (π).
- SỰ TỔ HỢP liên kết σ với liên kết π tạo thành liên kết ĐÔI hoặc liên kết BA.
1. LIÊN KẾT ĐƠN
- Liên kết đơn (hay liên kết σ) do một cặp electron CHUNG tạo nên.
- Được biểu diễn bằng MỘT GẠCH NỐI giữa hai nguyên tử.
- Liên kết σ là liên kết BỀN.
2. LIÊN KẾT ĐÔI
- Liên kết đôi do 2 cặp electron CHUNG giữa 2 nguyên tử tạo nên.
- Liên kết đôi gồm: 1 liên kết σ và 1 liên kết π.
- Liên kết n KÉM BỀN hơn liên kết σ nên dễ bị đứt ra trong các phản ứng hóa học.
- Được biểu diễn bằng HAI GẠCH NỐI song song giữa hai nguyên tử.
- Mỗi nguyên tử C của liên kết đôi còn tạo được HAI LIÊN KẾT ĐƠN với hai nguyên tử khác.
- 4 nguyên tử liên kết trực tiếp với 2 nguyên tử C của liên kết đôi nằm trong cùng mặt phẳng với hai nguyên tử cacbon đó.
3. LIÊN KẾT BA
- Liên kết ba do 3 cặp electron CHUNG giữa 2 nguyên tử tạo nên.
- Liên kết ba gồm 1 liên kết σ và 2 liên kết π.
- Được biểu diễn bằng BA GẠCH NỐI song song giữa hai nguyên tử.
- Mỗi nguyên tử C của liên kết ba còn tạo được MỘT liên kết đơn với một nguyên tử KHÁC.
- 2 nguyên tử liên kết với 2 nguyên tử C của liên kết ba nằm trên đường thẳng nối hai nguyên tử cacbon.
III. CTCT CỦA HỢP CHẤT HỮU CƠ
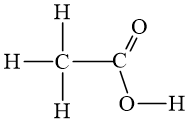
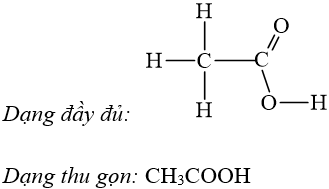
Cho biết trật tự liên kết của các nguyên tử trong phân tử. Khi viết CTCT phải nhất thiết đảm bảo đúng hóa trị của các nguyên tố. Có thể viết CTCT dưới dạng đầy đủ và rút gọn.
- Công thức khai triển: Biểu diễn trên mặt phẳng giấy tất cả các liên kết giữa các nguyên tử.
- Công thức CT thu gọn:
* Các nguyên tử hoặc nhóm nguyên tử cùng liên kết với một nguyên tử C được viết thành 1 nhóm.
* Hoặc chỉ biểu diễn liên kết giữa các nguyên tử C và với nhóm chức (mỗi đầu đoạn thẳng hoặc điểm gấp khúc là 1 cacbon, không biếu thị số nguyên tử H liên kết với cacbon).
VD: Viết công thức cấu tạo của axit axetic.