- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
AMIN
I. KHÁI NIỆM-DANH PHÁP
1. KHÁI NIỆM VÀ BẬC AMIN
|
Phân tử amoniac |
Thế 1H bởi R1 |
Thế 2H bới R1 và R2 |
Thế 3H bới R1, R2 và R3 |
| Bậc amin |
Amin bậc 1 |
Amin bậc 2 |
Amin bậc 3 |
VD: NH3 thay 1 H bằng 1 gốc hidrocacbon CH3-: CH3-NH2: metylamin
Nếu thay 2H bằng 2 gốc hidrocacbon CH3-: CH3-NH-CH3: dimetylamin.
- Amin là hợp chất hữu cơ được tạo ra khi THẾ một hoặc nhiều NGUYÊN TỬ HIĐRÔ trong phân tử amoniac bằng một hoặc nhiều gốc hiđrocacbon.
- Amin no, đơn chức, mạch hở CnH2n+3N (n > hoặc bằng 1)
2. PHÂN LOẠI
a. Theo đặc điểm cấu tạo của gốc hiđrocacbon
- Gốc hirocacbon no
- Gốc hirocacbon không no
- Gốc hirocacbon thơm.
b. Theo bậc của amin
- Bậc của amin: là số nguyên tử H trong phân tử NH3 bị thay thế bởi gốc hidrocacbon.
+ Amin bậc 1: R-NH2
+ Amin bậc 2: R-NH-R'
+ Amin bậc 3: R-N(R')-R''
-Ngoài ra, amin còn có thể được phân loại theo (amin, béo, amin thơm và amin dị vòng).
VD:
|
Dựa vào gốc R |
Gốc R |
Gốc R no |
Gốc R không no |
Gốc R thơm |
|
Amin |
Amin no |
Amin không no |
Amin thơm |
|
|
Dựa vào nhóm chức amin |
Số nhóm chức |
1 nhóm |
Từ 2 nhóm trở lên |
|
|
Amin |
Đơn chức |
Đa chức |
||
|
Dựa vào bậc amin |
Số gốc R |
1 gốc R |
2 gốc R |
3 gôc R |
|
Amin |
Amin bậc 1 |
Amin bậc 2 |
Amin bậc 3 |
|
|
|
Công thức
|
Amin no, đơn chức, bậc 1. CnH2n + 1 NH2 ; Hoặc R’ – NH2 |
|
|
3. TÊN AMIN
a. Cách gọi tên theo danh pháp gốc – chức :
ank + yl + amin
b. Cách gọi tên theo danh pháp thay thế :
ankan + vị trí + amin
c. Tên thông thường chỉ áp dụng với một số amin
|
Công thức cấu tạo |
Tên gốc – chức Tên gốc R ghép amin |
Tên thay thế Tên ankan ghép amin |
|
CH3 – NH2 |
Metyl amin |
Metan amin |
|
CH3 – CH2 – NH2 |
Etylamin |
Etanamin |
|
CH3 – NH – CH3 |
Đimetylamin |
N - Metylmetanamin |
|
CH3 – CH2 – CH2 – NH2 |
Porpylamin |
Propan – 1 - amin |
|
(CH3)3N |
Trimetylamin |
N,N - đimetylmatanamin |
|
CH3[CH2]3NH2 |
butylamin |
Butan – 1 - amin |
|
C2H5 – NH – C2H5 |
Đietylamin |
N - etanetylamin |
|
C6H5 – NH2 |
phenylamin |
benzenamin |
|
H2N[CH2]6NH2 |
hexametylenđiamin |
Hexa -1,6 - điamin |
II. TÍNH CHẤT VẬT LÍ
- Các amin có khả năng TAN tốt trong nước, do giữa amin và nước có liên kết Hiđro liên phân tử. Độ tan trong nước GIẢM khi số nguyên tử C TĂNG.
- Metyl–, đimetyl–, trimetyl– và etylamin là những chất KHÍ có mùi KHAI khó chịu, ĐỘC , DỄ tan trong nước, các amin đồng đẳng cao hơn là chất LỎNG hoặc RẮN
- Anilin là chất LỎNG, nhiệt độ sôi là 184oC, không màu, RẤT ĐỘC, ít tan trong nước, tan trong ancol và benzen.
II. TÍNH CHẤT HOÁ HỌC
a. Cấu tạo phân tử AMIN
- N trong phân tử amin còn có 1 cặp electron chưa tham gia liên kết → Amin có tính bazơ.
b. So sánh lực BAZƠ
- Mật độ electron càng LỚN thì lực bazơ càng MẠNH.
(C6H5)2NH < C6H5NH2 < H-NH2 < CH3-NH2 < (CH3)2NH
c. Giải thích
- Gốc PHENYL hút electron làm GIẢM mật độ e nên có lực bazơ YẾU hơn so với amoniac thì 2 gốc phenyl sẽ khiến cho lực bazơ của amin CÀNG YẾU hơn.
- Gốc ANKYL đẩy electron làm TĂNG mật độ e nên có lực bazơ MẠNH hơn amoniac thì 2 gốc ankyl sẽ khiến lực bazơ của amin MẠNH hơn nữa.
=>Vì vậy, anilin là một bazơ RẤT yếu và KHÔNG làm chất chỉ thị màu thay đổi.
* LƯU Ý : Amin bậc 3 do hiệu ứng không gian nên làm sai lệch độ mạnh bazơ của các amin.
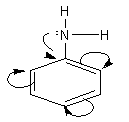
d. Cấu tạo phân tử ANILIN
- Do gốc PHENYL (C6H5–) HÚT cặp electron tự do của nitơ về phía mình, sự chuyển dịch electron theo hiệu ứng liên hợp p – p (chiều như mũi tên cong) làm cho mật độ electron trên nguyên tử nitơ GIẢM đi, khả năng nhận PROTON giảm đi.
=>Kết quả là làm cho tính bazơ của anilin RẤT yếu (KHÔNG làm xanh được quỳ tím, KHÔNG làm hồng được phenolphtalein).
- Nhóm amino (NH2) làm TĂNG khả năng thế Br vào gốc phenyl (do ảnh hưởng của hiệu ứng +C). Phản ứng THẾ xảy ra ở các vị trí ortho và para do nhóm NH2 đẩy electron vào làm mật độ electron ở các vị trí này tăng lên.
1. TÍNH BAZO
- Amin có tính BAZƠ YẾU
Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng LÀM XANH giấy quỳ tím hoặc làm hồng phenolphtalein.
R’NH2 + HOH →[R’NH3]+ + OH-
-Khả năng thủy phân của amin phụ thuộc vào gốc R’ : R’ no > R’ không no > R’ thơm.
Amin thơm không làm quì tím hóa xanh.
|
Ghi nhớ : Tính bazơ của các amin. R’no – NH2 > R’không no – NH2 > R’thơm – NH2 VD : CH3 – CH2 – NH2 > CH2 = CH – NH2 > C6H5 – NH2 R’no – NH2 < (R’no)2NH < (R’no)3N VD : C2H5NH2 < (C2H5)2NH < (C2H5)3N R’nhỏ - NH2 < R’lớn – NH2 VD: CH3 – NH2 < C3H7 – NH2 |
- Tác dụng với axit muối amoni
R’ – NH2 + HCl R’NH3Cl
VD : CH3NH2 + HCl → CH3NH3Cl (metyl amoni clorua)
C6H5NH2 + HCl → C6H5NH3Cl
Nhắc : Các muối R’NH3Cl là muối của bazơ yếu nên tác dụng với bazơ mạnh NaOH, KOH.
R’NH3Cl + NaOH R’NH2 + NaCl + H2O
VD : CH3NH3Cl + NaOH CH3 NH2 + NaCl + H2O
C6H5NH3Cl + NaOH C6H5NH2 + NaCl + H2O
-Tác dụng với NƯỚC → dung dịch bazơ
CH3NH2 + H2O CH3NH3+ + OH-
- Tác dụng với dung dịch MUỐI CỦA BAZƠ không tan tạo kết tủa.
3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3CH3NH3Cl
2. PHẢN ỨNG TRÊN GỐC R
CH2 = CH – NH2 + H2 →CH3 – CH2 – NH2
2,4,6 – tribrom anilin
Phản ứng trên dùng nhận biết anilin
IV. ỨNG DỤNG VÀ ĐIỀU CHẾ
1. ỨNG DỤNG
-Vì phần lớn các amin bây giờ ứng dụng nhiều làm chất TRUNG GIAN điều chế các chất khác có nhiều ứng dụng quan trọng hơn nhất là các acid amin, phẩm nhuộm, các chất lưu hóa cao su...chỉ có 1 số ít là có hoạt tính SINH HỌC.
2. ĐIỀU CHẾ
- Thay thế nguyên tử H của phân tử amoniac
![]()
- Khử hợp chất nitro
![]()