ĐIỆN LI
I. SỰ ĐIỆN LI
1. NGUYÊN NHÂN TÍNH DẪN ĐIỆN CỦA CÁC DUNG DỊCH
- TÍNH DẪN ĐIỆN của dung dịch axit, bazơ và muối là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là các ion.
- SỰ ĐIỆN LI là quá trình phân li các chất trong nước ra ion.
- Những chất tan trong nước phân li ra ION được gọi là những chất điện li.
=> Vậy axit, bazơ và muối là những chất điện li.
2. PHÂN LOẠI CÁC CHẤT ĐIỆN LI
|
CHẤT ĐIỆN LI MẠNH (α = 1) |
Chất điên li MẠNH là chất khi tan trong nước, các phân tử hòa tan ĐỀU phân li ra ion. Na2SO4 → 2Na+ + SO42- KOH → K+ + OH- HNO3 → H+ + NO3– |
|
CHẤT ĐIỆN LI YẾU (0 < α <1) |
Chất điện li YẾU là chất khi tan trong nước chỉ có MỘT PHẦN số phân tử hòa tan phân li ra ion. PHẦN CÒN LẠI vẫn tồn tại dưới dạng phân tử trong dung dịch. CH3COOH ⇄ CH3COO- + H+ HClO → H+ + ClO– |
SỰ ĐIỆN LI của chất điện li YẾU là quá trình THUẬN NGHỊCH.
ĐỘ ĐIỆN LI (α): α = n/no =C/Co
Với:
n là số phân tử phân li ra ion.
no là số phân tử hòa tan.
C là nồng độ mol chất tan phân li thành ion.
Co là nồng độ mol chất hòa tan.
CHÚ Ý:
- Khi pha loãng dung dịch, độ điện li của các chất điện li đều TĂNG.
- Cân bằng điện li là cân bằng động và tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê.
II. AXIT - BAZO - MUỐI
1. THEO A-RÊ-NI-UT
|
AXIT |
|
|
- AXIT là chất khi tan trong nước phân li ra cation H+ HCl → H+ + Cl– CH3COOH ⇄ H+ + CH3COO– - AXIT NHIỀU NẤC H3PO4 ⇄ H+ + H2PO4– H2PO4– ⇄ H+ + HPO42– HPO42– ⇄ H+ + PO43– Phân tử H3PO4 phân ly 3 nấc ra ion H+ nó là axit 3 nấc. - TÍNH CHẤT CỦA AXIT: Là tính chất của cation H+ trong dung dịch. |
| BAZƠ |
| - Là chất khi tan trong nước phân li ra anion OH-
Ba(OH)2 → Ba2+ + 2OH- - TÍNH CHẤT CỦA BAZƠ: Là tính chất của anion OH– trong dung dịch. |
| HIĐROXIT LƯỠNG TÍNH |
|
- Là hiroxit khi tan trong nước VỪA có thể phân li như axit, VỪA có thể phân li như bazơ. - HIĐROXIT LƯỠNG TÍNH THƯỜNG GẶP: Zn(OH)2, Al(OH)3, Pb(OH)2, Sn(OH)2, Cu(OH)2. - Chúng đều ÍT TAN trong nước và có lực axit BAZƠ YẾU. Zn(OH)2 có 2 kiểu phân li (tùy điều kiện).
Zn(OH)2 ⇄ Zn2+ + 2OH-
Zn(OH)2 ⇄ ZnO22- + 2H+ Có thể viết Zn(OH)2 dưới dạng H2ZnO2. |
| MUỐI |
|
- Là hợp chất khi tan trong nước phân li ra CATION KIM LOẠI (hoặc cation NH4+) và ANION GỐC AXIT.
KHSO4, NaHCO3, NaH2PO4…
NaCl, (NH4)2SO4… |
CHÚ Ý: Nếu anion gốc axit còn hiđro có tính axit, thì gốc này tiếp tục phân li yếu ra ion H+.
NaHSO4 → Na+ +HSO4-
HSO4- → H+ + SO42-
2. THEO BRÔN - STET
- Axit là chất nhường proton.
CH3COOH + H2O ⇄ H3O+ + CH3COO-
- Hằng số phân li axit: 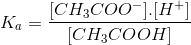 :
:
Giá trị Ka chỉ phụ thuộc vào bản chất axit và nhiệt độ. Ka càng nhỏ, lực axit của nó càng yếu.
- Bazơ là chất nhận proton.
NH3 + H2O ⇄ NH4+ + OH –
- Hằng số phân li bazơ: Kb = 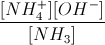
Giá trị Kb chỉ phụ thuộc vào bản chất bazơ và nhiệt độ. Kb càng nhỏ, lực bazơ của nó càng yếu.
III. SỰ ĐIỆN LI CỦA NƯỚC.PH
1. SỰ ĐIỆN LI CỦA NƯỚC
H2O ⇄ H+ + OH- (1)
TÍCH SỐ ION của nước: K= [H+][OH-] = 10-14 M (đo ở 25oC)
2. Ý NGHĨA TÍCH SỐ ION CỦA NƯỚC
- Môi trường axit : [H+] > [OH–] hay [H+] > 1,0.10–7M.
- Môi trường kiềm : [H+] < [OH–] hay [H+] < 1,0.10–7M.
- Môi trường trung tính : [H+] = [OH–] = 1,0.10–7M.
3. PH- CHẤT CHỈ THỊ MÀU
- Nếu [H+] = 1,0.10–a M thì pH = a.
- Về mặt toán học pH = -lg [H+]
[H+] = 10-3M, pH = 3: Môi trường axit.
pH + pOH = 14
CHÚ Ý:
- Thang pH thường dùng có giá trị từ 1 đến 14.
- Môi trường dung dịch được đánh giá dựa vào nồng độ H+ và pH dung dịch.
|
[H+] |
pH |
MÔI TRƯỜNG |
|
= 1,0.10-7M |
= 7 |
Trung tính |
|
> 1,0.10-7M |
< 7 |
Axit |
|
< 1,0.10-7M |
> 7 |
Bazơ |
- Chất chỉ thị màu thường dùng là quỳ tím và phenolphtalein.
| Qùy tím | Phenolphtalein |
|
Đỏ: pH ≤ 6 Tím: 6 < pH <8 Xanh: pH ≥ 8 |
Không màu: pH < 8,3 Hồng: pH ≥ 8,3 |
IV. PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH
1. ĐIỀU KIỆN XẢY RA PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH
- Phản ứng xảy ra trong DUNG DỊCH các chất điện li là phản ứng GIỮA CÁC ION.
- ĐK: các ion KẾT HỢP được với nhau tạo thành ÍT NHẤT một trong các chất sau: Chất kết tủa, chất khí, chất điện li yếu.
-
- Trường hợp tạo KẾT TỦA
AgNO3 + HCl → AgCl + HNO3
Cl– + Ag+ → AgCl (phương trình ion)
-
- Trường hợp tạo CHẤT KHÍ
2HCl + Na2CO3 → 2NaCl + CO2 ↑ + H2O
2H+ + CO32– → CO2 + H2O (phương trình ion)
-
- Trường hợp tạo CHẤT ĐIỆN LI YẾU
+ Phản ứng tạo thành NƯỚC
HCl + NaOH → NaCl + H2O
H+ + OH– ⇄ H2O (PHƯƠNG TRÌNH ION)
+ Phản ứng tạo thành AXIT YẾU :
HCl + CH3COONa → CH3COOH + NaCl
H+ + CH3COO- → CH3COOH (PHƯƠNG TRÌNH ION)
* LƯU Ý Trường hợp KHÔNG xảy ra phản ứng trao đổi ion.
NaCl + KOH → NaOH + KCl
Na+ + Cl- + K+ + OH- → Na+ + OH- + K+ + Cl-
2. PHẢN ỨNG THỦY PHÂN CỦA MUỐI
Có thể nghĩ rằng các dung dịch muối trung hòa đều là những môi trường TRUNG TÍNH (pH = 7).
NHƯNG điều này CHỈ ĐÚNG với những muối tạo nên bởi AXIT MẠNH và BAZƠ MẠNH.
VD. NaCl, BaCl2, K2SO4... Cho giấy quỳ tím vào dung dịch NaCl, giấy quỳ tím KHÔNG đổi màu.
Các muối như Na2CO3, K2S, CH3COONa... là muối của AXIT YẾU và BAZƠ MẠNH.
Dung dịch các muối này có pH > 7 (là môi trường BAZƠ).
=> Cho giấy quỳ tím vào dung dịch CH3COONa, giấy quỳ tím đổi thành màu XANH.
Giải thích như sau: Trong dung dịch
CH3COONa phân li thành các ion Na+và CH3COOˉ
Anion CH3COOˉ có vai trò như một BAZƠ
Nó NHẬN PROTON của nước theo phương trình phản ứng:
CH3COO- + HOH ⇄CH3COOH + OH-
Như vậy trong dung dịch CH3COONa nồng độ ion OHˉ lớn hơn 10-7, do vậy pH > 7.
Với những muối của AXIT MẠNH và BAZƠ YẾU như NH4Cl (amoni clorua), ZnCl2, Al2(SO4)3...
Thì dung dịch của chúng lại có pH < 7 (môi trường AXIT).
=> Cho giấy quỳ tìm vào dung dịch NH4Cl, giấy quỳ đổi thành màu HỒNG.
Giải thích như sau: trong dung dịch
NH4Cl phân li thành các ion NH4+ và Clˉ
cation NH4+có vai trò như một AXIT
Nó CHO PROTON theo phương trình phản ứng:
NH4+ + HOH ⇄ NH3 + H3O+
Như vậy trong dung dịch NH4Cl nồng độ ion H3O+ lớn hơn 10-7 (hoặc H+) do vậy dung dịch có pH < 7.
KẾT LUẬN : Phản ứng TRAO ĐỔI ION giữa muối và nước gọi là phản ứng THỦY PHÂN MUỐI.