CHƯƠNG 6: AXIT CACBOXYLIC
I. KHÁI NIỆM-ĐỒNG PHÂN-DANH PHÁP
1. KHÁI NIỆM
- Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm - COOH liên kết với gốc hiđrocacbon, với H hoặc với nhau.
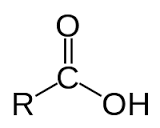
- Axit cacboxylic no, đơn chức, mạch hở: CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1).
VD: CH3-COOH: axit axetic
2. DANH PHÁP
- Tên thông thường của một số axit thường gặp
- Tên THÔNG DỤNG của các axit cacboxylic thường được đặt theo tên của nguồn gốc tìm ra chúng như:
HCOOH Axit fomic
CH3COOH Axit axetic
CH3CH2COOH Axit propionic
CH3CH2CH2COOH Axit butiric
CH2=CH-COOH Axit acrylic
CH2=C(CH3)-COOH Axit metacrylic
(COOH)2 Axit oxalic
C6H5COOH Axit benzoic
HOOC(CH2)4COOH Axit ađipic
C15H31COOH Axit pamitic
C17H35COOH Axit stearic
C17H33COOH Axit oleic
C17H31COOH Axit linoleic
- Tên thay thế
Tên thay thế = Tên hiđrocacbon tương ứng + oic
II. TÍNH CHẤT VẬT LÍ
- Nhiệt độ sôi
- Axit có nhiệt độ sôi CAO HƠN Ancol có khối lượng phân tử tương đương vì phân tử axit tạo được 2 LIÊN KẾT H và LIÊN KẾT H giữa các phân tử axit BỀN hơn liên kết H giữa các phân tử Ancol.
- Tính tan
- Từ C1 đến C3 TAN VÔ HẠN trong nước do có khả năng tạo liên kết H liên phân tử với nước.
- C4 đến C5 ÍT tan trong nước; từ C6 trở lên KHÔNG tan do gốc R cồng kềnh và có tính KỊ NƯỚC.
III. TÍNH CHẤT HOÁ HỌC
1. PHẢN ỨNG THỂ HIỆN TÍNH AXIT
Phân tử axit có nhóm cacbonyl C = O là nhóm hút e mạnh nên làm giảm mật độ e tự do trên nguyên tử O làm cho liên kết O - H bị phân cực hơn → dễ bị phân li thành H+ thể hiện tính axit.
RCOOH RCOO- + H+
Độ mạnh của axit PHỤ THUỘC vào độ linh động của nguyên tử H và độ tan của axit trong dung môi nước.
Nếu nhóm -COOH gắn với nhóm đẩy e (gốc hiđrocacbon no) thì tính axit yếu hơn so với HCOOH.
Gốc ankyl càng có nhiều nguyên tử H thì đẩy e càng mạnh làm cho tính axit càng giảm.
Nếu nhóm COOH gắn với nhóm hút e (gốc hiđrocacbon không no, gốc có chứa nhóm NO2, halogen, OH…) thì tính axit mạnh hơn so với HCOOH.
Càng nhiều gốc hút e thì tính axit càng MẠNH.
Gốc hút e càng mạnh thì tính axit càng mạnh, nhóm hút e nằm càng gần nhóm COOH thì làm cho tính axit của axit càng mạnh.
Axit làm quỳ tím chuyển thành màu HỒNG.
- Tác dụng với BAZƠ → muối + H2O
VD. CH3-COOH + NaOH → CH3-COONa + H2O
- Tác dụng với OXIT BAZƠ → muối + H2O
VD. 2CH3-COOH + CaO → (CH3-COO)2Ca + H2O
- Tác dụng với KIM LOẠI đứng trước H → muối + H2
VD. 2CH3-COOH + Mg → (CH3-COO)2Mg + H2
- Tác dụng với MUỐI của axit YẾU hơn (muối cacbonat, phenolat, ancolat) → muối mới + axit mới.
VD. 2CH3-COOH + Na2CO3 → 2CH3-COONa + CO2 + H2O
=> Thường dùng muối cacbonat hoặc hiđrocacbonat để NHẬN BIẾT các axit cacboxylic.
2. PHẢN ỨNG ESTE HÓA
(xúc tác H2SO4, t0)
VD: CH3-COOH + C2H5-OH CH3COOC2H5 + H2O
* Tổng quát
R(COOH)x + R’(OH)t Ry(COO)xyR’x + xyH2O
3. PHẢN ỨNG OXI HÓA HOÀN TOÀN
CxHyOz + (x + y/4 - z/2)O2 → xCO2 + y/2H2O
Nếu đốt cháy axit thu được nCO2 = nH2O thì axit thuộc loại no, đơn chức, mạch hở:
CnH2n+1COOH → (n + 1)CO2 + (n + 1)H2O
* LƯU Ý:
- HCOOH có phản ứng TƯƠNG TỰ như anđehit:
HCOOH + 2AgNO3 + 4NH3 + H2O → 2NH4NO3 + (NH4)2CO3 + 2Ag
- Các axit KHÔNG NO còn có các tính chất của hiđrocacbon tương ứng:
CH2=CH-COOH + Br2 dung dịch → CH2Br-CHBr-COOH
3CH2=CH-COOH + 2KMnO4 + 4H2O → 3CH2OH-CHOH-COOH + 2MnO2 + 2KOH
IV. ỨNG DỤNG-ĐIỀU CHẾ
1. ỨNG DỤNG
-Axit axetic được dùng để điều chế những chất có ứng dụng QUAN TRỌNG như: axit cloaxetic (dùng tổng hợp chất diệt cỏ 2,4−D;2,4,5−T...2,4−D;2,4,5−T...), dùng làm chất cầm màu khi nhuộm vải, sợi, xenlulozơ axetat,...
2. ĐIỀU CHẾ
- Oxi hóa anđehit (xúc tác Mn2+, t0)
CH3-CHO + 1/2O2 → CH3-COOH
- TỔNG QUÁT
R(CHO)x + x/2O2 → R(COOH)x
- Thủy phân este trong môi trường axit
CH3COOC2H5 + H2O CH3-COOH + C2H5-OH
- TỔNG QUÁT
Ry(COO)xyR’x + xyH2O yR(COOH)x + xR’(OH)y
- Thủy phân dẫn xuất 1,1,1 - trihalogen
RCCl3 + 3NaOH → RCOOH + 3NaCl + H2O (H2O)
- Riêng CH3COOH
n-C4H10 + 5/2O2 → 2CH3COOH + H2O (xúc tác Mn2+, t0)
C2H5OH + O2 → CH3COOH + H2O (men giấm)
- Một số phản ứng khác
C6H5-CH3 → C6H5COOK → C6H5COOH
R-X → R-CN → R-COOH
CH3OH + CO → CH3COOH