ĐIỆN PHÂN
I. SỰ ĐIỆN PHÂN CÁC CHẤT ĐIỆN LI
1. ĐIỆN PHÂN NÓNG CHẢY MUỐI CLORUA
Trong thực tế, người ta thường chỉ tiến hành điện phân những hợp chất (muối, bazơ, oxit) NÓNG CHẢY của các kim loại có tính KHỬ MẠNH như Li, Na, K, Ba, Ca, Mg, Al
TỔNG QUÁT: MCln → M+ Cl2
Catot (-): Mn++ ne → M
Anot (+): 2Cl-→ Cl2+ 2e
2. ĐIỆN PHÂN NÓNG CHẢY HIĐROXIT
(CHỈ áp dụng để điều chế các kim loại KIỀM: Na, K)
TỔNG QUÁT: MOH →M+O2 + 2H2O
Catot (-): M++1e→1M
Anot (+): 4OH-→ O2+ 2H2O + 4e
3. ĐIỆN PHÂN NÓNG CHẢY OXIT
2Al2O3 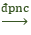
(Chỉ áp dụng điều chế Al)
VD. Điện phân Al2O3 nóng chảy trong thực tế cần thêm criolit (Na3AlF6)
SƠ ĐỒ ĐIỆN PHÂN:
2Al2O3 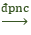
Catot ( – ) Anot ( + )
Al3+ + 3e → Al 2O2- → O2 + 4e
* Vai trò của criolit (Na3AlF6):
- Criolit (Na3AlF6) có vai trò quan trọng nhất là làm GIẢM nhiệt độ nóng chảy của Al2O3 từ 2050oC xuống khoảng 900oC.
- Làm TĂNG độ dẫn điện của hệ.
- TẠO LỚP NGĂN CÁCH giữa các sản phẩm điện phân và môi trường ngoài.
* CHÚ Ý nếu ANOT làm bằng THAN CHÌ:
- Nếu điện cực làm bằng GRAPHIT (THAN CHÌ) thì sẽ bị khí sinh ra ở anot ĂN MÒN.
- Khí ở anot sinh ra thường là HỖN HỢP khí CO, CO2 và O2.
II. ĐIỆN PHÂN DUNG DỊCH CÁC CHẤT ĐIỆN LI TRONG NƯỚC
- Trong quá trình ĐIỆN PHÂN dung dịch, NGOÀI các ion do chất điện li phân li ra còn có các ion H+ và OH- của nước.
- Do đó VIỆC XÁC ĐỊNH sản phẩm của sự điện phân phức tạp hơn.
- Tùy vào TÍNH KHỬ và TÍNH OXI HOÁ của các ion có trong dung dịch điện phân mà ta thu được những sản phẩm KHÁC NHAU.
VD. khi điện phân dung dịch NaCl, các
ION Na+, H+(H2O) di chuyển về CATOT
ION Cl-, OH- (H2O) di chuyển về ANOT
Cần xét xem ion nào sẽ phóng điện ở các điện cực.
- CƠ SỞ để giải quyết vấn đề này là dựa vào tính oxi hóa và tính khử của các CẶP OXI HOÁ - KHỬ .
- CHÚ Ý thứ tự cho và nhận electron:
+ CỰC ÂM (-): Chất có tính oxi hóa MẠNH hơn thì NHẬN ELECTRON TRƯỚC.
+ CỰC DƯƠNG (+): Chất có tính khử MẠNH hơn thì CHO ELECTRON TRƯỚC.
1. KHẢ NĂNG OXI HÓA CATION Ở CATOT(CỰC ÂM)
- Ở CATOT có thể xảy ra các quá trình khử sau đây:
Mn+ + ne → M
2H+(axit) + 2e → H2
Hoặc ion HIĐRÔ của nước bị khử: 2H2O + 2e → H2 + 2OH-
- Khả năng bị KHỬ của các ion kim loại như sau:
Các cation từ Zn2+ đến cuối dãy Hg2+, Cu2+, Fe3+, Ag+… DỄ bị khử nhất và thứ tự tăng dần
Từ Al3+ đến các ion đầu dãy Na+, Ca2+, K+ KHÔNG bị khử trong dung dịch
Các ion H+của axit DỄ bị khử hơn các ion H+ của nước
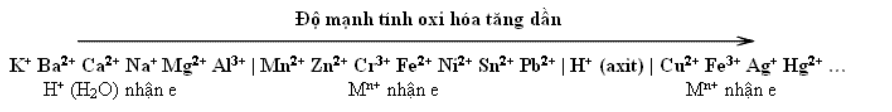
VD. khi điện phân dung dịch hỗn hợp chứa FeCl3, CuCl2 và HCl thì THỨ TỰ các ion bị khử là:
Fe3+ + 1e → Fe2+
Cu2+ + 2e → Cu
2H+ + 2e → H2
Fe2+ + 2e → Fe
2. KHẢ NĂNG KHỬ ANION Ở ANOT(CỰC DƯƠNG)
- Với ANOT TRƠ: Ở anot có thể xảy ra các quá trình KHỬ sau đây:
2Cl- → Cl2 + 2e
4OH- → O2 + 2H2O + 4e
Hoặc ION OH- của nước bị OXI HOÁ: 2H2O → O2+ 4H++ 4e
- Khả năng bị OXI HOÁ của các anion như sau:
-
- Các anion gốc axit không chứa oxi DỄ bị oxi hóa nhất theo thứ tự:
S2– > I– > Br– > Cl– > RCOO– > OH– > H2O.
- Các anion gốc axit như NO3-, SO42-, PO43-, CO32-, ClO4-…KHÔNG bị oxi hóa.
* Với ANOT TAN:
Nếu khi điện phân dùng các KIM LOẠI như Ni, Cu, Ag… ( trừ Pt) làm anot
Thì các kim loại này DỄ bị oxi hóa hơn các anion do đó chúng tan vào dung dịch (anot tan) theo sơ đồ:
M (anot) → Mn+(dd) + ne.
III. ĐỊNH LƯỢNG QUÁ TRÌNH ĐIỆN PHÂN
Muốn tính khối lượng các chất giải phóng ở các điện cực ta có thể tính theo phương trình điện phân.
Khi biết cường độ dòng điện (I) và thời gian điện phân (t) ta có thể tính theo công thức Faraday: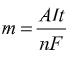 (*)
(*)
Trong đó:
m: khối lượng chất thu được ở điện cực ( gam)
A: Khối lượng nguyên tử (đối với kim loại) hoặc khối lượng phân tử (đối với chất khí) thu được ở điện cực
n: Số electron mà nguyên tử hoặc ion cho hoặc nhận
I: Cường độ dòng điện (ampe)
t: Thời gian điện phân (giây)
F: Hằng số Faraday (F = 96500)
- Số mol electron nhường hoặc nhận ở mỗi điện cực :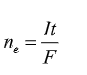
IV. ỨNG DỤNG
Sự điện phân có nhiều ứng dụng trong công nghiệp:
- ĐIỀU CHẾ CÁC KIM LOẠI
-
- Điện phân NÓNG CHẢY điều chế kim loại hoạt động RẤT MẠNH như KIM LOẠI KIỀM (Na, K..), kim loại NHÓM IIA (Mg,Ca,Ba...) và Al.
- Điện phân DUNG DỊCH điều chế các kim loại KÉM Al (đứng SAU NHÓM): Cu, Pb, Zn. Fe. Ag, Au…
- ĐIỀU CHẾ một số phi kim như: H2,O2, F2, Cl2.
- ĐIỀU CHẾ một số hợp chất như: NaOH, H2O2, nước Gia – ven.
- TINH CHẾ kim loại và tách riêng từng kim loại ra khỏi hợp kim
- Ứng dụng quan trọng của điện phân trong công nghiệp là MẠ ĐIỆN.
Điện phân với anot TAN được dùng trong mạ điện, nhằm BẢO VỆ kim loại khỏi bị ăn mòn và tạo vẻ đẹp cho vật mạ. ANOT là kim loại dùng để mạ (như mạ vàng) còn CATOT là vật cần mạ (cái thìa). Lớp mạ thường RẤT MỎNG, có độ dày từ 5.10-5 ÷ 1.103 cm.