CÂN BẰNG HÓA HỌC
I. CÁC KHÁI NIỆM
1. PHẢN ỨNG MỘT CHIỀU
Phản ứng CHỈ ra theo một chiều từ trái sang phải được gọi là PHẢN ỨNG MỘT CHIỀU.
CHẤT PHẢN ỨNG biến đổi HOÀN TOÀN thành chất sản phẩm và KHÔNG xảy ra theo chiều ngược lại.
2. PHẢN ỨNG THUẬN NGHỊCH
Là phản ứng hóa học trong đó chất phản ứng biến đổi thành chất sản phẩm và ĐỒNG THỜI chất sản phẩm lại phản ứng với nhau để biến thành chất tham gia phản ứng.
VD. Cl2 + H2O ⇌ HCl + HClO
Chiều mũi tên từ trái sang phải là chiều phản ứng THUẬN.
Chiều mũi tên từ phải sang trái là chiều phản ứng NGHỊCH.
3. CÂN BẰNG HÓA HỌC
Là trạng thái của phản ứng THUẬN NGHỊCH, ở đó trong cùng một đơn vị thời gian có bao nhiêu phân tử chất sản phẩm được hình thành từ những chất ban đầu thì có bấy nhiêu phân tử chất sản phẩm phản ứng với nhau để tạo thành chất ban đầu.
=> Trạng thái này của phản ứng thuận nghịch được gọi là CÂN BẰNG HOÁ HỌC.
Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận BẰNG tốc độ phản ứng nghịch.
II. HẰNG SỐ CÂN BẰNG HÓA HỌC
1. CÂN BẰNG TRONG HỆ ĐỒNG THỂ
HỆ ĐỒNG THỂ là hệ mà các tính chất lí học và hóa học đều như nhau ở mọi vị trí trong hệ.
VD: hệ gồm các chất khí, hệ gồm các chất tan trong dung dịch.
Giả sử có một phản ứng THUẬN NGHỊCH sau:
aA + bB ⇌ cC + dD
A, B, C, D là những chất khí hoặc những chất tan trong dung dịch phản ứng ở trạng thái cân bằng, ta có:
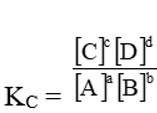
Trong đó:
[A], [B], [C], [D] là nồng độ mol/l của các chất A, B, C và D.
a, b, c, d là hệ số các chất trong phương trình phản ứng.
Hằng số cân bằng K của phản ứng xác định chỉ phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ chất phản ứng.
- Trường hợp cân bằng được thiết lập giữa các chất khí, người ta có thể thay nồng độ các chất trong biểu thức tính K bằng áp suất riêng phần của hỗn hợp.
2. CÂN BẰNG TRONG HỆ DỊ THỂ
HỆ DỊ THỂ là hệ mà các tính chất lí học hóa học là không giống nhau ở mọi vị trí trong hệ.
VD: hệ gồm chất rắn và chất khí; hệ gồm chất rắn và chất tan trong nước.
Xét hệ cân bằng sau:
C(r) + CO2 (k) ⇌ 2CO (k)
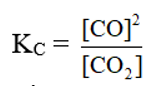
Nồng độ các chất rắn được coi là hằng số.
III. SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
1. ĐỊNH NGHĨA
Sự chuyển dịch cân bằng hóa học là SỰ PHÁ VỠ trạng thái cân bằng CŨ để chuyển sang một trạng thái cân bằng MỚI do các yếu tố bên ngoài tác động lên cân bằng.
2. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN CÂN BẰNG HÓA HỌC
Các yếu tố nồng độ, áp suất và nhiệt độ ảnh hưởng đến cân bằng hóa học đã đc nhà hóa học Pháp Le Chatrlier tổng kết thành nguyên kí được gọi là nguyên lí Le Chatrlier như sau:
Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ, sẽ chuyển dịch cân bằng theo chiều làm GIẢM tác động bên ngoài đó.
-
Khi TĂNG nồng độ một chất, cân bằng chuyển dịch theo chiều làm GIẢM nồng độ chất đó
-
Khi GIẢM nồng độ một chất, cân bằng chuyển dịch theo chiều làm TĂNG nồng độ chất đó
-
Khi TĂNG nhiệt độ của hệ, cân bằng chuyển dịch theo chiều THU nhiệt.
-
Khi GIẢM nhiệt độ của hệ, cân bằng chuyển dịch theo chiều TỎA nhiệt.
-
Nếu phản ứng THUẬN là tỏa nhiệt thì phản ứng NGHỊCH là phản ứng thu nhiệt (hoặc ngược lại )
-
Khi TĂNG áp suất của hệ, cân bằng chuyển dịch theo chiều làm GIẢM số phân tử khí.
-
Khi GIẢM áp suất của hệ, cân bằng chuyển dịch theo chiều làm TĂNG số phân tử khí.
-
Đối với hệ phản ứng THUẬN NGHỊCH mà có số phân tử khí ở phản ứng thuận bằng số phân tử khí ở phản ứng nghịch , thì áp suất KHÔNG làm chuyển dịch cân bằng.
3. VAI TRÒ CHẤT XÚC TÁC
Chất xúc tác KHÔNG làm biến đổi nồng độ các chất trong cân bằng và KHÔNG làm biến đổi hằng số cân bằng nên KHÔNG làm cân bằng chuyển dịch.Chỉ đẩy nhanh tốc độ cân bằng chuyển dịch.