- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
ANKEN
I. CTCT - DANH PHÁP
1. CẤU TẠO
- Mạch C HỞ, có thể PHÂN NHÁNH hoặc KHÔNG PHÂN NHÁNH.
- Trong phân tử có 1 liên kết đôi: gồm 1 liên kết XÍCH MA và 1 liên kết PI.
- Nguyên tử C ở liên kết đôi tham gia 3 liên kết nhờ 3 obitan lai hoá sp2, còn liên kết nhờ obitan p không lai hoá.
- Đặc biệt phân tử CH2 = CH2 có cấu trúc PHẲNG.
- Hiện tượng đồng phân do: MẠCH CACBON khác nhau, VỊ TRÍ của nối đôi khác nhau. Nhiều anken có đồng phân cis - trans.
VD. But - 2 - en
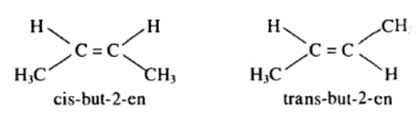
2. CÁCH GỌI TÊN
a) Mach C không nhánh: Tên mạch C + số chỉ cị trí nối đôi + en.
b) Mach C có nhánh: Số chỉ vị trí nhánh – tên nhánh + Tên mạch chính + số chỉ vị trí nối đôi + en.
* Mạch chính là mạch có nối đôi với số thứ tự của C ở nối đôi nhỏ nhất
3. ĐỒNG ĐẲNG ĐỒNG PHÂN
- ĐỒNG ĐẲNG
C2H4 CH2=CH2 etilen
C3H6 CH3-CH=CH2 propilen
C4H8 ... CnH2n (n ≥ 2) dãy đồng đẳng của etilen (anken hay olefin).
- ĐỒNG PHÂN
CnH2n có 2 loại đồng phân
- Đồng phân xicloankan (n ≥ 3)
- Đồng phân anken
+ Đồng phân CẤU TẠO: Bao gồm đồng phân vị trí liên kết đôi và đồng phân mạch C.
+ Đồng phân HÌNH HỌC: Bao gồm đồng phân cis và trans
ĐIỀU KIỆN để anken có đồng phân hình học là: Mỗi nguyên tử cacbon ở liên kết ĐÔI liên kết với hai nguyên tử hoặc nhóm nguyên tử KHÁC NHAU.
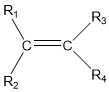
R1 ≠ R2 và R3 ≠ R4
- Cis là hai nhóm nguyên tử có khối lượng lớn nằm cùng mặt phẳng liên kết pi.
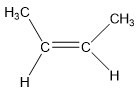 Đồng phân Cis
Đồng phân Cis
- Trans thì ngược lại
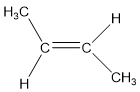
Đồng phân Trans
II. TÍNH CHẤT VẬT LÍ
- Theo chiều TĂNG của n (trong công thức CnH2n), nhiệt độ sôi và nhiệt độ nóng chảy TĂNG.
- n = 2 - 4 : chất khí
- n = 5 - 18 : chất lỏng.
- n ≥ 19 : chất rắn.
- Đều ÍT TAN trong nước, TAN được trong một số dung môi hữu cơ (rượu, ete,…)
III. TÍNH CHẤT HOÁ HỌC
1. PHẢN ỨNG CỘNG HỢP
- CỘNG HỢP H2: (điều kiện phản ứng Ni, t0) → ankan
CH2=CH2 + H2 → CH3-CH3
TỔNG QUÁT: CnH2n + H2 → CnH2n+2
- CỘNG HỢP HALOGEN:
CH2=CH2 + Br2 → CH2Br-CH2Br
TỔNG QUÁT: CnH2n + Br2 → CnH2nBr2
* NHẬN XÉT:
- Dung dịch brom là THUỐC THỬ dùng để nhận biết etilen và anken nói chung.
- Mức độ phản ứng của halogen GIẢM DẦN từ Flo,Clo, Brom,Iot.
- CỘNG HỢP HIDROHALOGENUA
CH2=CH2 + HCl → CH3-CH2Cl
- ĐỒNG ĐẲNG CỦA ETILEN
CH3-CH=CH2 + HCl → CH3-CH2-CH2-Cl
(Sản phẩm PHỤ)
→ CH3-CHCl-CH3
(Sản phẩm CHÍNH)
* LƯU Ý:
- Theo dãy HCl, HBr, HI phản ứng DỄ dần.
- Phản ứng CỘNG HX vào anken bất đối tạo ra HỖN HỢP 2 sản phẩm.
- Đối với các anken KHÁC BẤT ĐỐI XỨNG khi cộng HX sẽ tuân theo quy tắc Maccôpnhicôp.
- Nếu thực hiện phản ứng CỘNG HBr vào anken có xúc tác PEOXIT thì sản phẩm chính lại NGƯỢC quy tắc Maccopnhicop.
* Quy tắc cộng Maccôpnhicôp: Trong phản ứng cộng HX vào liên kết ĐÔI, nguyên tử H ưu tiên cộng vào nguyên tử Cacbon bậc THẤP HƠN, còn nguyên tử hay nhóm nguyên tử X ưu tiên cộng vào nguyên tử Cacbon bậc CAO HƠN.
- CỘNG HỢP H2O (đun nóng, có axit loãng xúc tác)
CH2=CH2 + H2O → CH3-CH2OH
- ĐỒNG ĐẲNG CỦA ETILEN
CH3-CH=CH2 + H2O → CH3-CH2-CH2-OH
(Sản phẩm phụ)
→ CH3-CHOH-CH3
(Sản phẩm chính )
2. PHẢN ỨNG TRÙNG HỢP
- Có XÚC TÁC, áp suất CAO, ĐUN NÓNG
nCH2=CH2 → (-CH2–CH2-)n (Polietylen hay PE)
nCH2=CH–CH3 → (-CH2–CH(CH3)-)n (Polipropilen hay PP)
- SƠ ĐỒ phản ứng TRÙNG HỢP:
nA → (B)n (t0, xt, p)
- Phản ứng TRÙNG HỢP: Là quá trình CỘNG HỢP liên tiếp nhiều phân tử NHỎ giống nhau hoặc tương tự nhau tạo thành phân tử LỚN (hợp chất cao phân tử).
3. PHẢN ỨNG OXI HOÁ
a. Phản ứng oxi hóa KHÔNG HOÀN TOÀN:
- Tạo thành ancol ĐA CHỨC có 2 nhóm -OH hoặc đứt mạch C chỗ nối đôi tạo thành ANDEHIT hoặc AXIT.
VD. 3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2KOH + 2MnO2
* TỔNG QUÁT:
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MnO2
* NHẬN XÉT: Anken làm MẤT MÀU dung dịch thuốc tím nên có thể dùng dung dịch thuốc tím để NHẬN BIẾT anken.
- RIÊNG CH2=CH2 còn có phản ứng oxi hóa KHÔNG HOÀN TOÀN tạo CH3CHO.
CH2=CH2 + 1/2O2 → CH3CHO (PdCl2, CuCl2, t0)
b. Phản ứng CHÁY:
- Phương trình TỔNG QUÁT:
CnH2n + 3n/2O2 → nCO2 + nH2O
- Đặc điểm phản ứng đốt cháy anken: nCO2 = nH2O.
IV. ĐIỀU CHẾ
1. PHÒNG THÍ NGHIỆM
- TÁCH NƯỚC từ ancol etylic:
C2H5OH → C2H4 + H2O (H2SO4 đặc, ≥ 1700C)
* TỔNG QUÁT:
CnH2n+1OH → CnH2n + H2O (H2SO4 đặc, ≥ 1700C)
2. CÔNG NGHIỆP
- Thu từ nguồn khí chế biến dầu mỏ.
- Tách H2 khỏi ankan:
CnH2n+2 → CnH2n + H2 (Fe, t0)
- Tách HX từ dẫn xuất CnH2n+1X:
CnH2n+1X + NaOH → CnH2n + NaX + H2O (ancol)
V. ỨNG DỤNG
- Dùng để SẢN XUẤT rượu, các dẫn xuất halogen và các chất khác.
- Để TRÙNG HỢP polime: polietilen, poliprpilen.
- Etilen còn được dùng làm quả MAU CHÍN.