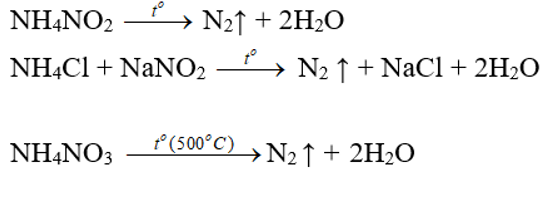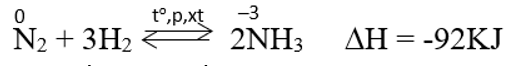- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
NITO
I. CẤU TẠO PHÂN TỬ
- Nhóm VA có cấu hình electron ngoài cùng là: ns2np3 => vừa thể hiện được tính oxh và tính khử.
- Cấu hình electron của N2: 1s22s22p3.
- CTCT: N ≡ N.
- CTPT: N2.
- Số oxh của N2: -3, 0, +1, +2, +3, +4, +5.
II. TÍNH CHẤT VẬT LÝ
- Là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở -1960C.
- Nitơ ít tan trong nước, hoá lỏng và hoá rắn ở nhiệt độ rất thấp.
- KHÔNG duy trì sự cháy và sự hô hấp.
III. TÍNH CHẤT HÓA HỌC
1. TÍNH OXI HÓA
| Phân tử nitơ có liên kết ba rất bền (ở 3000oC nó chưa bị phân hủy), nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường. | |
| TÁC DỤNG VỚI HIDRO |
- Ở nhiệt độ cao, áp suất cao và có xúc tác. - Nitơ phản ứng với hiđro tạo amoniac. - Đây là phản ứng thuận nghịch và toả nhiệt:
|
| TÁC DỤNG VỚI KIM LOẠI |
- Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua. 6Li + N2 → 2Li3N. - Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại. 3Mg + N2 → Mg3N2 (magie nitrua). |
2. TÍNH KHỬ
- Ở nhiệt độ cao (3000oC) Nitơ phản ứng với oxi tạo nitơ monoxit.
N2 + O2 ---> 2NO (không màu)
- Ở điều kiện thường, Nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
2NO + O2 ---> 2NO2
Chú ý : Các oxit khác của nitơ : N2O , N2O3, N2O5 không điều chế được trực tiếp từ niơ và oxi.
IV. ĐIỀU CHẾ
1. TRONG CÔNG NGHIỆP
- Nitơ được sản xuất bằng cách chưng cất phân đoạn không khí lỏng.
2. TRONG PHÒNG THÍ NGHIỆM
- Đun dung dịch bão hòa muối amoni nitrit (Hỗn hợp NaNO2 và NH4Cl):