- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
AMONIAC VÀ MUỐI AMONI
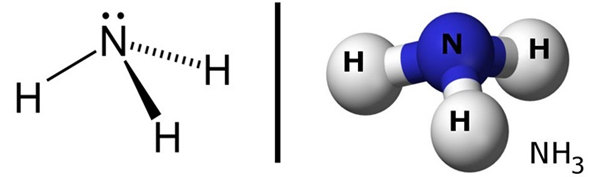
- Trong phân tử NH3, có N liên kết với ba nguyên tử hidro bằng ba liên kết cộng hóa trị CÓ CỰC.
- NH3 có cấu tạo hình chóp với nguyên tử Nitơ ở ĐỈNH
- Nitơ còn một cặp electron hóa trị là nguyên nhân gây ra tính bazơ của NH3.
I. TÍNH CHẤT VẬT LÍ
- NH3 là một chất khí không màu, có mùi khai và sốc, nhẹ hơn không khí.
- Tan nhiều trong nước cho môi trường bazơ yếu.
- Dung dịch bão hòa có nồng độ 25% (D = 0,91 g/cm3).
II. TÍNH CHẤT HÓA HỌC
1. AMONIAC CÓ TÍNH BAZO YẾU
- Amoniac có tính bazơ nên dd amoniac làm quỳ tím hóa xanh, dd phenolphlatein chuyển thành hồng.
=> Để phát hiện amoniac, người ta dùng quỳ tím ẩm để nhận biết.
- Nguyên nhân: do cặp e chưa tham gia liên kết ở nguyên tử N.
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
| PHẢN ỨNG VỚI NƯỚC | NH3 + H2O ⇔ NH4+ + OH- |
| PHẢN ỨNG VỚI AXIT |
Amoniac phản ứng với Axit → Muối Amoni NH3 (khí) + HCl (khí) → NH4Cl (khói trắng) NH3 + H2SO4 → NH4HSO4 2NH3 + H2SO4 → (NH4)2SO4 |
| TÁC DỤNG VỚI DD MUỐI |
Amoniac tác dụng với dung dịch muối của kim loại mà hidroxit không tan → bazơ và muối NH3 + Muối (dung dịch) → Bazơ + Muối mới 2NH3+ MgCl2 + 2H2O → Mg(OH)2 + 2NH4Cl 3NH3 + AlCl3+ 3H2O →Al(OH)3↓ + 3NH4Cl |
|
* CHÚ Ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2. ZnSO4+ 2NH3+ 2H2O → Zn(OH)2↓ + (NH4)2SO4 Zn(OH)2 + 4NH3 → [Zn(NH3)3](OH)2 |
|
2. AMONIAC PHẢN ỨNG VỚI NƯỚC
Nguyên nhân: do N trong NH3 có mức oxi hóa thấp nhất -3
| TÁC DỤNG VỚI O2 |
4NH3 + 3O2 →2N2↑ + 6H2O 4NH3 + 5O2 →4NO↑ + 6H2O |
| TÁC DỤNG VỚI Cl2 |
2NH3 + 3Cl2 →N2↑ + 6HCl 8NH3 + 3Cl2 → N2↑ + 6NH4Cl |
| TÁC DỤNG VỚI OXIT CỦA KIM LOẠI | 3CuO + 2NH3 →Cu + 3H2O + N2↑ |
3. KHẢ NĂNG TẠO PHỨC
-Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
VD:
- Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
- Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
4. PHẢN ỨNG VỚI KIM LOẠI TẠO MUỐI NITRUA
Na+NH3 →NaNH2+H2
Na2NH+H2
Na3N+H2
III. ĐIỀU CHẾ
- Điều chế NH3 trong công nghiệp: Tổng hợp từ N2và H2
N2 + 3H2 → 2NH3 (4500C; Fe, p)
- Điều chế amoniac trong phòng thí nghiệm
-
- Cho muối amoni tác dụng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 + H2O
-
- Nhiệt phân muối amoni
NH4Cl →NH3+ HCl
NH4HCO3 →NH3 + H2O + CO2