- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
Dạng 2: HỖN HỢP KIM LOẠI,OXIT KIM LOẠI TÁC DỤNG VỚI AXIT
HỖN HỢP KIM LOẠI,OXIT KIM LOẠI TÁC DỤNG VỚI AXIT
Fe+O2➜(Fe,FeO.Fe2O3,Fe3O4)+H2SO4đ/HNO3➜Muối+ Sản phẩm khử+ nước
Kim loại tác dụng với dung dịch HNO3
Sản phẩm khử :
+ NO2: khí màu nâu
+ NO: khí không màu, hóa nâu trong không khí
+ N2O: khí không màu, gây cười
+ N2: khí không màu
+ NH4NO3: muối tan trong dung dịch
Sản phẩm khử của N+5 tùy thuộc vào độ mạnh của kim loại và nồng độ của dung dịch axit. Thông thường thì dung dịch đặc tạo NO2, loãng tạo NO, kim loại có tính khử càng mạnh thì N bị khử xuống mức càng sâu.
Kim loại tác dụng với dung dịch H2SO4
Sản phẩm khử :
+ SO2: khí mùi sốc (mùi hắc)
+ S: kết tủa vàng
+ H2S: khí mùi trứng thối
- Tổng số mol H2SO4 phản ứng bằng = nSO42- trong muối + n của sản phẩm khử( SO2, S, H2S)
- Tổng số mol HNO3 phản ứng = nNO3- trong muối + n của sản phẩm khử( NO2, NO, N2O, N2,NH3)
+Nếu sản phẩm khử là N2, N2O thì phải nhân thêm 2
VD: 2N+5 → N2 + 10e
+ Tất cả các chất khi tác dụng với 2 axit trên đều lên mức oxi hóa cao nhất
+ Ion NO3- trong môi trường H+ có tính oxi hóa như HNO3 loãng
VD: NaNO3 trong H2SO4 loãng
+ Nếu một bài toán có nhiều quá trình oxi hóa khử chúng ta chỉ cần để ý đến số oxi hóa của nguyên tố đó trước và sau phản ứng, sau đó dùng định luật bảo boàn e áp dụng chung cho cả bài toán
+ Khi Fe tác dụng với HNO3, nếu sau phản ứng Fe còn dư thì Fe sẽ tác dụng với Fe(NO3)3 tạo thành Fe(NO3)2
+ Riêng với Fe2+vẫn còn tính khử nên khi tác dụng với NO3- trong H+ thì đều tạo ra Fe3+
PHƯƠNG PHÁP GIẢI
-Tối ưu sử dụng phương pháp quy đổi
-CÁC CÁCH
Quy đổi với hỗn hợp oxit sắt
Fe +<O>➜ FeO
Fe2O3 +dd HNO3 ➜ Muối + sản phẩm khử+ H2O
Fe3O4
Fe
Các cách quy đổi
Cách 1: ta có thể quy đổi hỗn hợp ban đầu về các hỗn hợp khác đơn giản gồm hai chất (Fe và Fe2O3; FeO và Fe2O3 ; Fe3O4 và Fe2O3; Fe và FeO; Fe và Fe3O4 ; FeO và Fe3O4 hoăc thậm chí chỉ một chất FexOy
Cách 2: Quy đổi hỗn hợp thành Fe và O
Fe: x mol
O: y mol
BÀI 1:
Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hòa tan m gam hỗn hợp X vào dung dich HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
Quy hỗn hợp X về một chất FexOy:
FexOy + (6x - 2y) HNO3 → xFe(NO3)3 + (3x - 2y) NO2 + (3x -y) H2O
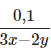 mol 0,1mol
mol 0,1mol
Bảo toàn Fe
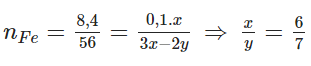
Fe6O7 (M = 448)
![]()
=> mX = 0,025 . 448 = 11,2g
BÀI 2:
Hòa tan hết m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4 bằng HNO3 đặc nóng thu được 4,48 lít khí NO (đktc). Cô cạn dung dịch sau phản ứng thu được 145,2 gam muối khan. Giá trị của m là:
A. 35,7 gam. B. 46,4 gam. C. 15,8 gam. D. 77,7
gam.
![]()
Khối lượng muối thu được chỉ chứa Fe(NO3)3 → nFe(NO3)3 = 145,2 : 242= 0,6 mol
Coi hỗn hợp X chứa Fe: 0,6 mol và O: x mol
Bảo toàn electron : → 0,6×3= 2x+ 0,2 ×3 → x = 0,6 mol
→ m= mFe + mO = 0,6×56 + 0,6×16 = 43,2 gam
BÀI 3
Hòa tan 3 gam hỗn hợp A gồm kim loại R hóa trị I và kim loại M hóa trị II vừa đủ vào dung dịch chứa HNO3 và H2SO4 và đun nóng, thu được 2,94 gam hỗn hợp khí B gồm NO2 và SO2. Thể tích của B là 1,344 lít (đktc). Khối lượng muối khan thu được là ?
Gọi nNO2 = a mol; nSO2 = b mol
=> mB = 46a + 64b = 2,94 (1)
nB = a + b = 0,06 mol (2)
Từ (1) và (2) => a = 0,05; b = 0,01
Ta có: nNO3 = ne NO2 nhận = 0,05 mol
nSO4 = ne SO2 nhận / 2 = 0,01.2 / 2 = 0,01
Bảo toàn khối lượng: mmuối = mkim loại + mgốc NO3 + mgốc SO4 = 3 + 0,05.62 + 0,01.96 = 7,06
Đáp án cần chọn là: C