- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
CACBON MONOXIT
I. CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT VẬT LÍ
1. CẤU TẠO PHÂN TỬ
- Cấu tạo của CO là C≡O (trong đó có 1 liên kết thuộc kiểu cho - nhận).
2. TÍNH CHẤT VẬT LÍ
- CO là chất khí, không màu, không mùi, không vị, TAN RẤT ÍT trong nước và RẤT BỀN VỚI NHIỆT.
- CO là KHÍ ĐỘC vì nó kết hợp với hemoglobin ở trong máu → hợp chất bền
=> hemoglobin mất tác dụng vận chuyển khí O2.
I. TÍNH CHẤT HOÁ HỌC
1. LÀ OXIT TRUNG TÍNH
- CO là oxit trung tính
- KHÔNG có khả năng tạo muối → không tác dụng với dung dịch bazơ và dung dịch axit ở nhiệt độ thường.
2. CÓ TÍNH KHỬ MẠNH
- Tác dụng với các phi kim:
2CO + O2 → 2CO2 (700ºC)
CO + Cl2 → COCl2 (photgen)
- CO khử oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại (phản ứng xảy ra ở nhiệt độ cao).
3CO + Fe2O3 → 3CO2 + 2Fe
CO + CuO → CO2 + Cu
- Nhận biết CO
PdCl2 + CO + H2O → Pd↓+ 2HCl + CO2
(↓ Vàng)
III. ĐIỀU CHẾ
1. PHÒNG THÍ NGHIỆM
HCOOH → CO + H2O (H2SO4 đặc, tº)
2. TRONG CÔNG NGHIỆP
-Khí CO được điều chế theo hai phương pháp:
- Trong công nghiệp
- Khí than ướt
![]()
-
- Khí lò gas
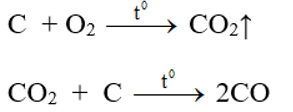
- Trong phòng thí nghiệm:
HCOOH → CO + H2O (H2SO4 đặc, tº)