- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
LƯU HUỲNH
I. TÍNH CHẤT VẬT
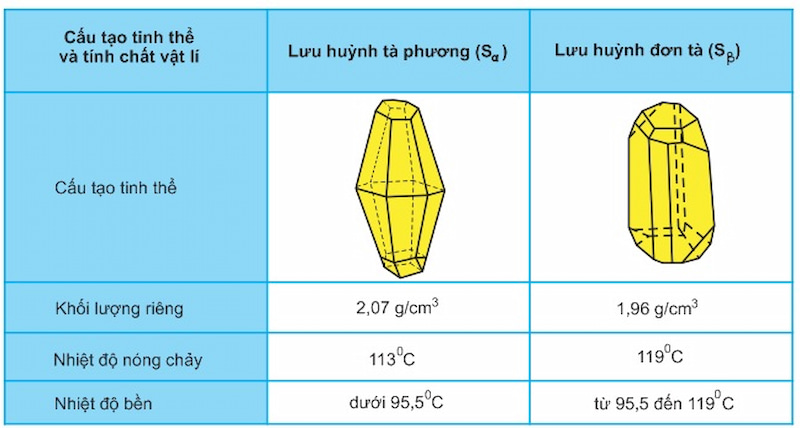
1. HAI DẠNG THÙ HÌNH CỦA LƯU HUỲNH
- Lưu huỳnh có 2 dạng thù hình:
Lưu huỳnh tà phương (Sα).
Lưu huỳnh đơn tà (Sβ).
- Chúng KHÁC NHAU về cấu tạo tinh thể và 1 số tính chất vật lí NHƯNG có tính chất hóa học GIỐNG NHAU.
- Chúng biến đổi qua lại với nhau theo nhiệt độ.
2. TÍNH CHẤT VẬT LÍ CỦA LƯU HUỲNH
II. TÍNH CHẤT HOÁ HỌC
1. TÁC DỤNG VỚI KIM LOẠI VÀ HIDRO
Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
- Tác dụng với hiđro:
H2 + S → H2S (350oC)
- Tác dụng với kim loại (có t0, tạo sản phẩm có số oxh thấp của kim loại).
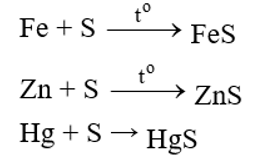
(Thủy ngân sunfua, phản ứng xảy ra ở nhiệt độ thường nên thường dùng S khử độc Hg)
CHÚ Ý
- Một số muối sunfua có màu đặc trưng:
CuS, PbS, Ag2S (màu đen)
MnS (màu hồng)
CdS (màu vàng)
=> Thường được dùng để nhận biết gốc sunfua.
- Muối sunfua được chia thành 3 loại:
Loại 1. Tan trong nước gồm Na2S, K2S, CaS và BaS, (NH4)2S.
Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS, ...
Loại 3. Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S, ...
2. TÁC DỤNG VỚI PHI KIM VÀ HỢP CHẤT
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa.
- Tác dụng với oxi:
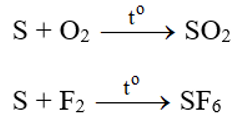
- Tác dụng với các chất có tính oxi hóa mạnh:
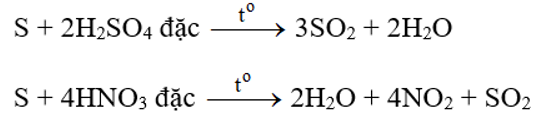
III. ỨNG DỤNG
S là nguyên liệu quan trọng cho nhiều ngành công nghiệp.
-
- Điều chế H2SO4.
- Dùng để lưu hóa cao su.
- Chế tạo diêm.
- Sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu, diệt nấm, ...
IV. SẢN XUẤT
- Đốt H2S trong điều kiện thiếu không khí.
2H2S + O2 → 2S + 2H2O.
- Dùng H2S để khử SO2.
2H2S + SO2 → 3S + 2H2O.
Phương pháp này giúp thu hồi trên 90% lượng S có trong các khí thải độc hại SO2 và H2S.