- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
KIM LOẠI KIỀM
I. VỊ TRÍ - TÍNH CHẤT VẬT LÍ
1. VỊ TRÍ VÀ CẤU TẠO
| VỊ TRÍ | - Nhóm IA, đứng ở mỗi đầu chu kì (trừ chu kì 1 ) |
| CẤU TẠO | 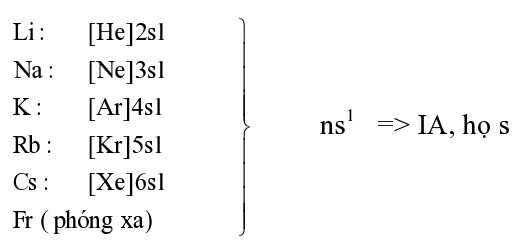 |
| NHẬN XÉT: Có 1e lớp ngoài cùng (RẤT ÍT) nhưng BÁN KÍNH nguyên tử lớn (LỚN NHẤT) so với các nguyên tố cùng 1 chu kì.
=> DỄ tách khỏi nguyên tử (năng lượng ion hóa NHỎ). M → M+ + 1e |
|
2. TÍNH CHẤT VẬT LÍ
- Các kim loại kiềm có cấu tạo mạng tinh thể LẬP PHƯƠNG TÂM KHỐI là kiểu mạng KÉM đặc khít (rỗng và xốp).
- LIÊN KẾT KIM LOẠI trong mạng tinh thể kim loại kiềm KÉM bền vững.
- NHIỆT ĐỘ NÓNG CHẢY, NHIỆT ĐỘ SÔI THẤP (giảm từ Li đến Cs).
- Khối lượng riêng NHỎ (TĂNG từ Li đến Cs, do bán kính nguyên tử TĂNG, cấu trúc KÉM đặc khít).
- Độ cứng THẤP (do lực liên kết nguyên tử YẾU).
II. TÍNH CHẤT HOÁ HỌC
1. TÁC DỤNG VỚI NƯỚC
- LITI: viên liti CHẠY trên mặt nước và BỐC CHÁY
- NATRI: khá GIỐNG với Li, đám cháy LÂU hơn và gây ra vụ nổ NHỎ
- KALI: vụ nổ LỚN, phản ứng vô cùng MÃNH LIỆT
* TỔNG QUÁT: 2M + 2H2O → 2MOH + H2
2. TÁC DỤNG VỚI AXIT
- Kim loại kiềm dễ dàng KHỬ H+ của dung dịch axit của HCl, H2SO4 thành H2 (phản ứng gây NỔ nguy hiểm).
2Na + 2HCl → 2NaCl + H2
3. TÁC DỤNG VỚI MUỐI
- HẦU HẾT các kim loại kiềm có thể KHỬ được các PHI KIM.
-
- Tác dụng với OXI → HỖN HỢP oxit và peoxit
4Na + O2 → 2Na2O
2Na + O2 → Na2O2
-
- Tác dụng với HALOGEN → MUỐI HALOGENUA
2Na + Cl2 → 2NaCl
-
- Tác dụng với LƯU HUỲNH → MUỐI SUNFUA
2Na + S → 2Na2S
III. ỨNG DỤNG
- KIM LOẠI KIỀM có nhiều ứng dụng quan trọng:
-
- Chế tạo HỢP KIM có nhiệt độ nóng chảy THẤP dùng trong thiết bị báo cháy,...
- Các kim loại KALI và NATRI dùng làm CHẤT TRAO ĐỔI NHIỆT trong một vài lò phản ứng hạt nhân.
- Kim loại XESI dùng chế tạo tế bào quang điện.
- Kim loại KIỀM được dùng để điều chế một số kim loại HIẾM bằng phương pháp NHIỆT LUYỆN.
- Kim loại KIỀM được dùng nhiều trong TỔNG HỢP hữu cơ.
IV. ĐIỀU CHẾ
- Phương pháp thường dùng để điều chế kim loại kiềm là ĐIỆN PHÂN nóng chảy MUỐI HALOGENUA của kim loại kiềm.
Điện phân nóng chảy muối NaCl
Catot ( – ) NaCl
Anot ( + )
2 Na+ + e → Na 2Cl- → Cl2 + 2e
Phương trình điện phân là
2NaCl → 2Na + Cl2