- TIẾNG VIỆT
- TIẾNG ANH
- TOÁN PHỔ THÔNG
- TOÁN LOGIC
- TOÁN SỐ LIỆU
- VẬT LÝ
- HÓA HỌC
- NGUYÊN TỬ
- BẢNG TUẦN HOÀN NGUYÊN TỐ HÓA HỌC
- TỐC ĐỘ PHẢN ỨNG
- CÂN BẰNG HÓA HỌC
- ĐIỆN LI
- ĐIỆN PHÂN
- LIÊN KẾT HÓA HỌC
- PHẢN ỨNG HÓA HỌC
- HÓA HỌC VÔ CƠ
- HÓA HỌC HỮU CƠ
- SINH HỌC
- ĐỊA LÍ
- LỊCH SỬ
DÃY ĐIỆN HOÁ CỦA KIM LOẠI
I. DÃY ĐIỆN HÓA CỦA KIM LOẠI
1. CẶP OXI HOÁ KHỬ CỦA KIM LOẠI
- Cu → Cu2+ + 2e (kim loại đồng NHƯỜNG e: thể hiện tính KHỬ).
- Cu2+ + 2e → Cu (ion Cu2+ NHẬN e: thể hiện tính OXI HÓA).
=> Cu ⇄ Cu2+ + 2e
- Cu dạng KHỬ
- Cu2+ dạng ÔXI HOÁ
- Nguyên tử kim loại DỄ NHƯỜNG electron để trở thành ion kim loại.
M → Mn+ + ne
- Ngược lại, ion kim loại có thể NHẬN electron để trở thành nguyên tử kim loại.
Mn+ + ne → M
* TỔNG QUÁT: M ⇄ Mn+ + ne
2. SO SÁNH TÍNH CHẤT CỦA CÁC CẶP OXI HOÁ KHỬ
- Thực nghiệm cho thấy Cu tác dụng được với dung dịch muối AgNO3 theo phương trình:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Cu + 2Ag+ → Cu2+ + 2Ag
- Trong khi đó
Cu2+ + Ag → không xảy ra.
* NHẬN XÉT: ion Cu2+ có tính oxi hóa YẾU hơn ion Ag+ và kim loại Cu có tính khử mạnh hơn kim loại Ag.
3. DÃY ĐIỆN HOÁ CỦA KIM LOẠI
- Người ta đã so sánh tính chất của nhiều cặp OXI HOÁ - KHỬ và sắp xếp thành dãy điện hóa của kim loại:

II. Ý NGHĨA
- DỰ ĐOÁN được chiều của phản ứng.
- QUY TẮC α:
Khử mạnh + oxi hóa mạnh → Khử yếu + oxi hóa yếu
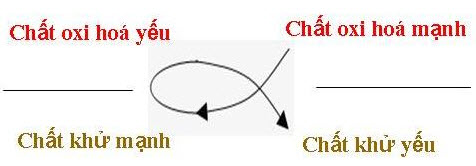
LƯU Ý:
VỊ TRÍ của các cặp oxi hóa - khử
Fe2+/Fe;...Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag.
Cho chúng ta XÁC ĐỊNH được:
- Fe khử được Fe3+ thành Fe2+ :
Fe + 2Fe3+ → 3Fe2+
- Fe khử được Cu2+ thành Fe2+ và Cu:
Fe + Cu2+ → Fe2+ + Cu
- Cu khử được Fe3+ :
Cu + Fe3+ → Cu2+ + 2Fe2+
- Fe khử Ag+ thành Fe2+ và nếu dư Ag+ thì phản ứng tiếp tục xảy ra thành Fe3+
Fe + 2Ag+ → Fe2+ + 2Ag
Fe2+ + Ag+ dư → Fe3+ + Ag