Dạng 1: TÌM NGUYÊN TỐ HOÁ HỌC, XÁC ĐỊNH VỊ TRÍ TRONG BẢNG
I. XÁC ĐỊNH NGUYÊN TỐ
- Đối với 82 nguyên tố đầu tiên trong bảng tuần hoàn, giữa số proton và nơtron có mối liên hệ :
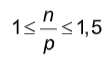
- Nếu đề cho biết các thông tin về mối liên quan giữa các hạt cơ bản của nguyên tử, phân tử; thành phần phần trăm về khối lượng của nguyên tử trong phân tử. Thì ta thiết ta lập hệ phương trình liên quan đến các hạt cơ bản của nguyên tử, phân tử. Sau đó giải hệ phương trình để tìm số proton của các nguyên tử.
- Hai nguyên tố ở cùng một nhóm và ở hai chu kì kế tiếp thì cách nhau 8 hoặc 18 nguyên tố.
II. XÁC ĐỊNH VỊ TRÍ
- Đối với nguyên tố nguyên tố s, p (thuộc nhóm A) :
+ Ô nguyên tố = số p = số electron = số hiệu nguyên tử.
+ Số thứ tự của chu kì = số lớp electron.
+ Số thứ tự của nhóm = số electron ở lớp ngoài cùng.
- Đối với nguyên tố d (thuộc nhóm B)
+ Việc xác định ô nguyên tố và chu kì tương tự như đối với nguyên tố s, p.
+ Số thứ tự của nhóm phụ thuộc vào số electron trên các phân lớp (n-1)dxnsy (n4) :
x + y < 8 thì nguyên tố thuộc nhóm (x + y).
8≤x + y≤ 10 thì nguyên tố thuộc nhóm VIII.
x + y >10 thì nguyên tố thuộc nhóm [(x + y) – 10].
VÍ DỤ
Cho biết tổng số electron trong anion là 42. Trong các hạt nhân A và B đều có số proton bằng số nơtron.
1.Tìm số khối của A và B
2.Cho biết vị trí của A, B trong bảng tuần hoàn.
1.Gọi số hạt proton của A là p và của B là p’, ta có :
p + 3p’ = 42 - 2. Ta thấy 3p’ < p + 3p’ = 40 nên p’ < = 13,3.
Do B tạo được anion nên B là phi kim. Mặt khác p’ < 13,3 nên B chỉ có thể là nitơ, oxi hay flo.
- Nếu B là nitơ (p’ = 7) p = 19 (K). Anion là : loại.
- Nếu B là oxi (p’ = 8) p = 16 (S). Anion là : thỏa mãn.
- Nếu B là flo (p’ = 9) p = 13 (Al). Anion là : loại.
Vậy A là lưu huỳnh, số khối A = 32. B là oxi, số khối A = 16.
2.O (p’ = 8) : 1s22s22p4 (ô số 8, chu kỳ 2, nhóm VIA)
S (p = 16) : 1s22s22p63s23p4 (ô số 16, chu kỳ 3, nhóm VIA)
VÍ DỤ 2
Tổng số hạt proton, nơtron, electron của nguyên tử một nguyên tố R nhóm VIIA là 28.
1.Tính số khối của R.
2.Viết ký hiệu nguyên tử nguyên tố đó.
1.Gọi tổng số hạt proton, nơtron, electron của nguyên tử R là p, n, e. Trong đó p = e.
Theo bài: p + n + e = 28
=> 2p + n = 28
=> n = 28 - 2p.
Mặt khác, p ≤ n ≤ 1,5p
=>p ≤28 - 2p ≤ 1,5p
=>8 ≤ p ≤9,3.
Vậy p = 8 hoặc 9. Do nguyên tố R thuộc nhóm VIIA nên nguyên tử nguyên tố R có 7 electron ở lớp ngoài cùng. Suy ra p = 9 :1s22s22p5. Vậy p = e = 9; n = 10.
Số khối A = n + p = 19.
2.Ký hiệu nguyên tử:
Nguyên tố đã cho là flo.
VÍ DỤ 3
Một hợp chất ion được cấu tạo từ M+ và X2-. Trong phân tử M2X có tổng số hạt proton, nơtron, electron là 140 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt. Số khối của ion M+ lớn hơn số khối của ion X2- là 23. Tổng số hạt proton, nơtron, electron trong ion M+ nhiều hơn trong ion X2- là 31.
1.Viết cấu hình electron của M và X.
2.Xác định vị trí của M và của X trong bảng tuần hoàn.
Gọi tổng số hạt proton, nơtron, electron của nguyên tử M là p, n, e và của nguyên tử X là p’, n’, e’. Ta có p = e và p’ = e’.
Theo giả thiết ta có :
2(p + n + e) + p’ + n’ + e’ = 140 =>4p + 2p’ + 2n + n’ = 140 (1)
2(p + e) + p’ + e’ - 2n - n’ = 44 =>4p + 2p’ - 2n - n’ = 44 (2)
p + n - p’ - n’ = 23 =>p + n - p’ - n’ = 23 (3)
(p + n + e - 1) - (p’ + n’ + e’ + 2) = 31 =>2 p + n - 2 p’ - n’ = 34 (4)
Từ (1) và (2) ta có : 2p + p’ = 46 và 2n + n’ = 48.
Từ (3), (4) ta có: p - p’ = 11 và n - n’ = 12.
Giải ra ta được p = 19 (K); n = 20 ; p’ = 8 (O); n’ = 8. Vậy X là K2O.
Cấu hình electron :
K (p = 19): 1s22s22p63s23p64s1 (chu kỳ 4, nhóm IA).
O (p’ = 8): 1s22s22p4 (chu kỳ 2, nhóm VIA)
VÍ DỤ 4
A và B là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32.
Hãy viết cấu hình electron của A , B và của các ion mà A và B có thể tạo thành.
A và B là hai nguyên tố ở cùng một phân nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn nên số thứ tự của chúng hơn kém nhau 8 hoặc 18 đơn vị (đúng bằng số nguyên tố trong một chu kỳ).
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
- Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron :
A : 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 và B2+: 1s22s22p63s23p6.
- Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; ZB = 25.
Cấu hình electron :
A : 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.
VÍ DỤ 5
Hai nguyên tố A và B ở hai nhóm A liên tiếp trong bảng tuần hoàn, B thuộc nhóm VA, ở trạng thái đơn chất A, B không phản ứng với nhau. Tổng số proton trong hạt nhân nguyên tử của A và B là 23.
1.Viết cấu hình electron nguyên tử của A, B.
2.Từ các đơn chất A, B và các hóa chất cần thiết, hãy viết các phương trình hóa học (ghi rõ điều kiện) điều chế hai axit trong đó A và B có số oxi hóa cao nhất.
1.Hai nguyên tố A và B ở hai nhóm A liên tiếp trong bảng tuần hoàn, B thuộc nhóm VA, do đó A thuộc nhóm IVA hoặc nhóm VIA.
Theo giả thiết : ZA + ZB = 23.
Vì: ZA + ZB = 23 và B thuộc nhóm V, còn A thuộc nhóm IV hoặc nhóm VI nên A, B thuộc các chu kì nhỏ (chu kỳ 2 và chu kỳ 3).
Mặt khác, A và B không thể cùng chu kỳ vì hai nguyên tố thuộc hai nhóm A kế tiếp trong một chu kỳ hơn kém nhau 1 proton, nghĩa là ở ô số 11 và 12 (tổng số proton bằng 23), không thuộc các nhóm IV và V hay V và VI.
- Trường hợp 1: B thuộc chu kỳ 2. Theo bài, B ở nhóm VA nên ZB = 7 (nitơ). Vậy ZA = 23 - 7 = 16 (lưu huỳnh). Trường hợp này thỏa mãn vì ở trạng thái đơn chất nitơ không phản ứng với lưu huỳnh.
Cấu hình electron của A và B là :
A: 1s22s22p63s23p4 và B: 1s22s22p3
- Trường hợp 2: B thuộc chu kỳ 3. Theo giả thiết, B ở nhóm VA nên ZB = 15 (phopho). Vậy ZA = 23 - 15 = 8 (oxi). Trường hợp này không thỏa mãn vì ở trạng thái đơn chất oxi phản ứng với phopho.
2.Điều chế HNO3 từ N2 và H2SO4 từ S.
Điều chế HNO3: N2 ➜ NH3 ➜ NO ➜ NO2 ➜HNO3
N2 + 3H2 ➜ 2NH3
4NH3 + 5O2 ➜4NO + 6H2O
2NO + O2 ➜ 2NO2
4NO2 + O2 + 2H2O ➜ 4HNO3
Điều chế H2SO4: S ➜ SO2 ➜ SO3 ➜ H2SO4
S + O2 ➜ SO2
2SO2 + O2 ➜ 2SO3