BÀI TẬP VỀ CÂN BẰNG HOÁ HỌC
Các bài tập về cân bằng hóa học hầu hết là bài tập lý thuyết hỏi về chuyển dịch cân bằng.
Chúng ta áp dụng
Nguyên lí chuyển dịch cân bằng (Lơ satơliê) :
Một phản ứng thuận nghịch đang ở trạng thái cân bằng , khi chịu một tác động từ bên ngoài như biến đổi (nồng độ , nhiệt độ , áp suất ); cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
|
|
Thay đổi |
Chuyển dời theo chiều |
|
Nồng độ |
Tăng [A] Giảm [A] |
Giảm [A] Tăng [A] |
|
Áp suất |
Tăng áp suất Hạ áp suất |
Giảm số phân tử khí Tăng số phân tử khí |
|
Nhiệt độ |
Tăng nhiệt độ Hạ nhiệt độ |
Thu nhiệt Phát nhiệt |
Đặc biệt nhớ câu: TĂNG THU DƯƠNG- GIẢM TỎA ÂM
Khi TĂNG nhiệt độ, phản ứng xảy ra theo chiều THU nhiệt tức là CHIỀU ∆H>0(DƯƠNG)
Khi GIẢM nhiệt độ, phản ứng xảy ra theo chiều TỎA nhiệt tức là CHIỀU ∆H<0(ÂM)
Ngoài ra, còn có bài tập về hằng số cân bằng
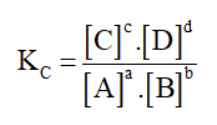
Trong đó:
Kc là hằng số cân bằng
[A], [B], [C], [D] là nồng độ mol của A, B, C, D
a, b, c, d là các hệ số trong phương trình hóa học cân bằng.
Bài 1:
a) Cr + H2O k ⇋CO k + H2 k H = 131kJ/mol , b) CO k + H2O k ⇋ CO2 k + H2 k H= -41KJ/mol
Các cân bằng dịch chuyển như thế nào khi biến đổi 1 trong các điều kiện sau :
* Tăng nhiệt độ * Thêm lượng hơi nước vào
* Lấy bớt H2 ra * Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống
a)
- Tăng nhiệt độ phản ứng xảy ra theo chiều thu nhiệt, tức là chiều thuận.
- Thêm hơi nước, phản ứng xảy ra theo chiều giảm lượng hơi nước tức là chiều thuận.
- Lấy bớt H2 phản ứng xảy ra theo chiều tăng tức là chiều thuận.
- Số mol khí trước phản ứng bé hơn số mol khí sau phản ứng nên
Khi tăng áp suất phản ứng xảy ra theo chiều giảm số mol khí tức là chiều nghịch.
b)
- Tăng nhiệt độ phản ứng xảy ra theo chiều thu nhiệt, tức là chiều nghịch.
- Thêm hơi nước, phản ứng xảy ra theo chiều giảm lượng hơi nước tức là chiều thuận.
- Lấy bớt H2 phản ứng xảy ra theo chiều tăng H2 tức là chiều thuận.
- Số mol khí trước phản ứng bằng hơn số mol khí sau phản ứng nên
Khi tăng áp suất, phản ứng không thay đổi chiều.
BÀI 2
Ở một nhiệt độ nhất định, phản ứng thuận nghịch N2(k) + 3H2(k) ⇔ 2NH3(k)
đạt trạng thái cân bằng khi nồng độ của các chất như sau:
[H2] = 2,0 mol/lít. [N2] = 0,01 mol/lít. [NH3] = 0,4 mol/lít.
Hằng số cân bằng ở nhiệt độ đó và nồng độ ban đầu của N2 và H2.
A. 2 và 2,6 M.
B. 3 và 2,6 M.
C. 5 và 3,6 M.
D. 7 và 5,6 M.
- Hằng số cân bằng 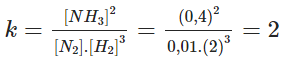
N2 (k) + 3H2 (k) ⇄ 2NH3
(bđ) x y (M)
(pư) 0,2 ← 0,6 ← 0,4 (M)
(cb) 0,01 2,0 0,4
[N2] = 0,21M. [H2] = 2,6M
BÀI 3
Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3 M và 0,7 M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở t0C, H2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng KC ở t0C của phản ứng có giá trị là
A.2,500
B. 0,609
C. 0,500
D. 3,125
Gọi lượng N2 phản ứng là x
N2 + 3H2 ⇔ 2NH3
Bđ 0,3 0,7 0
Pư x 3x 2x
Cb (0,3 – x) (0,7 – 3x) 2x
0,7 – 3x = 0,5(0,7 – 3x + 0,3 – x + 2x)
x = 0,1
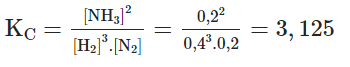
Đáp án D
BÀI 4
Cho cân bằng hoá học: N2 (k) + 3H2 (k) 2NH3 (k); phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
A.thay đổi áp suất của hệ.
B. thay đổi nồng độ N2.
C.thay đổi nhiệt độ.
D. thêm chất xúc tác Fe.
Cân bằng hóa học chỉ có thể bị chuyển dịch khi thay đổi các yếu tố nồng độ, nhiệt độ và áp suất. Chất xúc tác chỉ có vai trò làm tăng tốc độ phản ứng (thuận và nghịch) mà không làm cho cân bằng chuyển dịch!
Đây là một bài khá dễ, vì các phản ứng thường dùng để hỏi về cân bằng Hóa học rất quen thuộc và có thể giới hạn được như: phản ứng tổng hợp NH3, tổng hợp SO3, nhiệt phân CaCO3, ....
BÀI 5
Cho cân bằng 2SO2 (k) + O2 (k) ⇔2SO3 (k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là :
A.Phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
B.Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
C.Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
D.Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
MTB của hỗn hợp khí SO2, O2, SO3 phụ thuộc vào tỉ lệ số mol của chúng (MO2 = 32< MTB < MSO3 = 64). Khi tăng nhiệt độ tỉ khối của hỗn hợp so với H2 giảm, tức là M giàm. Có nghĩa là số mol SO3 giảm. Vậy khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch là chiều thu nhiệt, suy ra chiều thuận là chiều toả nhiệt.